細胞內氧化還原穩態對維持細胞的正常生理功能至關重要,針對腫瘤細胞內氧化還原穩態調控的抗癌療法近年來受到廣泛關注。谷胱甘肽(Glutathione, GSH)和還原型硫氧還蛋白 (Thioredoxin, Trx) 是細胞內重要的抗氧化分子。GSH或Trx的耗竭將導致細胞內活性氧自由基 (ROS)濃度升高,進而產生氧化應激,造成腫瘤細胞死亡;同時降低GSH和Trx的濃度/活性具有協同殺傷腫瘤細胞的作用。GSH和Trx抗氧化系統的循環需要“還原型煙酰胺腺嘌呤二核苷酸磷酸” (Nicotinamide adenine dinucleotide phosphate, NADPH) 的參與,NADPH的消耗將抑制GSH和Trx抗氧化系統的正常功能。NADPH消耗引發的GSH和Trx衰竭會誘發細胞死亡 (Ferroptosis)。鐵死亡是一種二價鐵依賴的新型細胞死亡模式,其在形態、生化和遺傳特征上都與其它細胞死亡途徑不同。細胞鐵死亡的發生依賴于特定脂質過氧化物的累積和/或谷胱甘肽過氧化物酶4 (Glutathione peroxidase 4, GPX4) 及鐵死亡抑制蛋白-1的缺失/失活。因此,通過選擇性衰竭NADPH來誘導或增敏鐵死亡有望實現對腫瘤的高效治療。
近日,天津大學趙燕軍/王征教授團隊設計并制備了含有偶氮苯和硝基咪唑的雙重缺氧敏感兩親性高分子膠束,包載小分子鐵死亡誘發劑RSL3 (簡稱DHM/RSL3),并系統研究了該載體的抗腫瘤效果 (圖1)。研究人員采用缺氧敏感的偶氮苯共價連接具有生物相容性的聚乙二醇 (PEG)和聚天冬氨酸作為高分子主鏈,側鏈共價連接缺氧敏感的硝基咪唑基團,兩親性高分子自組裝形成雙重缺氧敏感的納米膠束 (只含有硝基咪唑的單重缺氧敏感載藥膠束作為對照,簡稱HM@RSL3)。缺氧敏感的偶氮苯和硝基咪唑基團的引入是這一工作的亮點,當載藥膠束通過被動靶向效應累積到腫瘤后,腫瘤組織內的缺氧微環境使得膠束外層的親水性PEG脫落,從而促進細胞對載體的攝取。疏水硝基咪唑入胞后在缺氧環境中被還原成親水性的氨基咪唑,使高分子親水性增加,進而誘發膠束解組裝和藥物快速應答釋放。其次,偶氮苯和硝基咪唑基團的還原會導致腫瘤細胞內NADPH的衰竭,進而降低胞內的GSH和Trx濃度,間接促進腫瘤細胞鐵死亡。因此,缺氧敏感高分子載體可以選擇性增敏鐵死亡誘發劑RSL3的抗腫瘤療效。
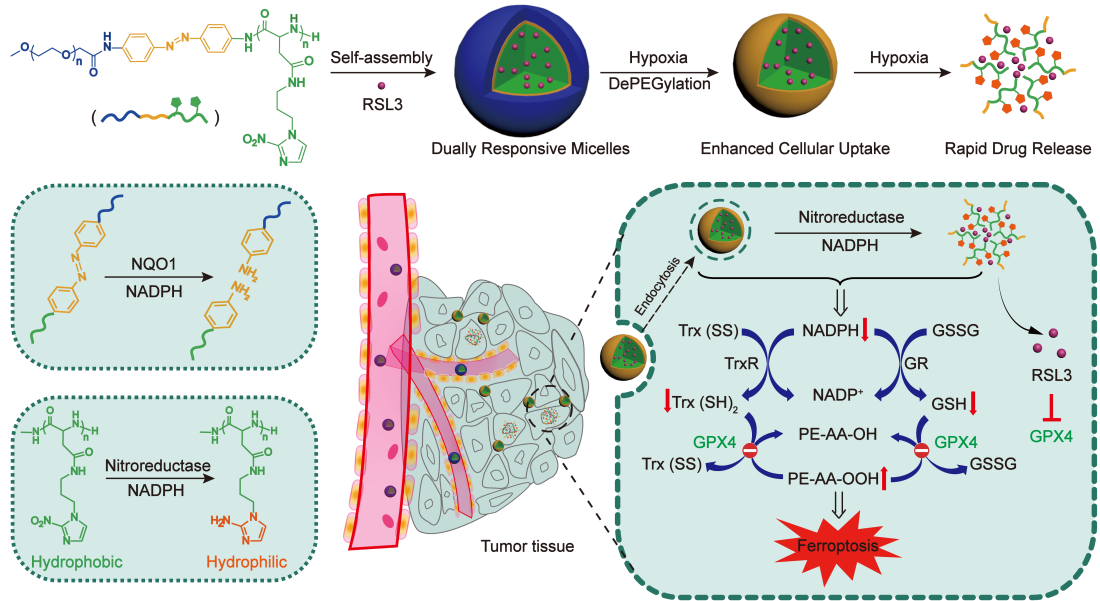
圖1. 雙重缺氧敏感高分子增敏細胞鐵死亡示意圖。
針對這一缺氧敏感的新型鐵死亡納米膠束載體,研究人員首先通過各項體外實驗證明了DHM@RSL3膠束的粒徑、形貌和穩定性。采用硫代硫酸鈉模擬缺氧環境,疏水的硝基咪唑基團可被還原成親水的氨基咪唑,進而造成載體崩解,促進藥物釋放 (圖2)。

圖2. 缺氧敏感高分子膠束的理化表征。
其次,研究人員利用熒光 (羅丹明B/RhoB)標記的納米膠束考察了偶氮苯基團在缺氧條件下促進載體入胞的效能。所選細胞為小鼠乳腺癌細胞(4T1)。在常氧條件下,4T1細胞對于DHM@RhoB膠束和HM@RhoB膠束的攝取沒有差別。然而,在缺氧條件下細胞對雙敏感載體DHM@RhoB的攝取量要大于對不含偶氮苯基團載體HM@RhoB的攝取量。這是由于在缺氧條件下偶氮苯的偶氮鍵會被還原斷裂從而導致親水PEG脫落,進而增強細胞攝取 (圖3)。研究人員還采用熒光共振能量轉移 (FRET) 技術考察了缺氧條件下兩種載體的解組裝行為,發現缺氧敏感載體在缺氧條件下快速崩解 (圖4)。

圖3. 包載羅丹明B的缺氧敏感高分子膠束在常氧和缺氧條件下的細胞攝取。

圖4. 包載FRET熒光分子的缺氧敏感高分子膠束在常氧和缺氧條件下的解組裝。
隨后,研究人員通過多類實驗手段和工具發現空白缺氧載體和載藥缺氧載體均可降低腫瘤細胞內NADPH,GSH,Trx的含量,進而抑制GPX4的活性并導致ROS的累積 (圖5-6)。線粒體電鏡圖片顯示腫瘤細胞的線粒體變小,膜密度增高,嵴減少,具有鐵死亡的典型特征 (圖6)。
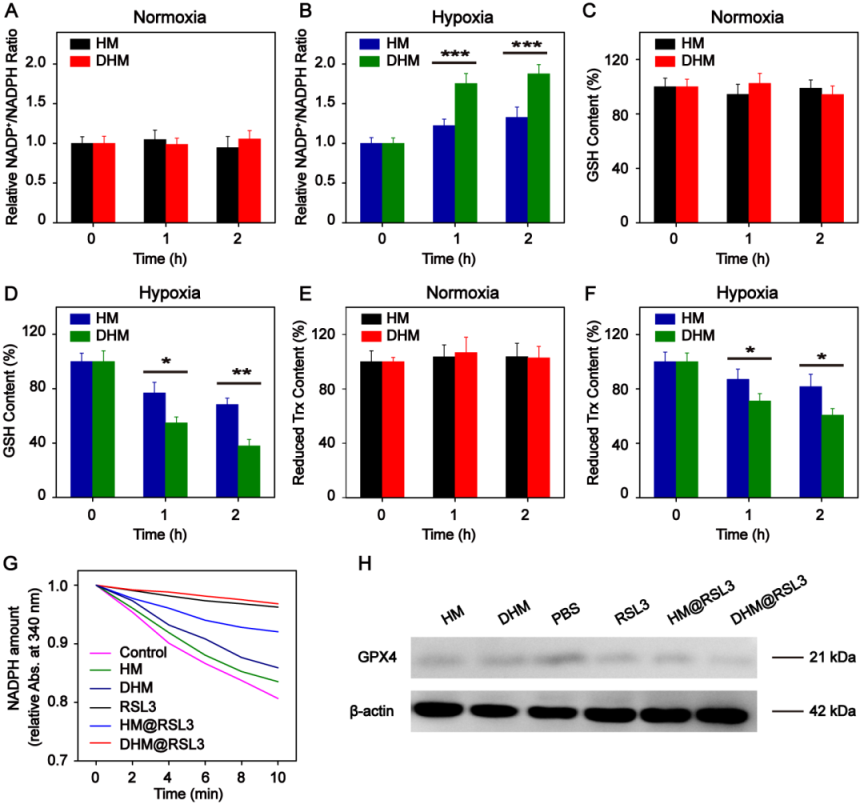
圖5. 缺氧敏感高分子膠束誘導的細胞鐵死亡。

圖6. 缺氧敏感高分子膠束誘導的ROS累積和線粒體碎片化。
研究人員不僅檢測了游離藥物、空白載體、載藥載體HM@RSL3和DHM@RSL3的細胞毒性,還利用LipeFluo熒光探針分析了細胞內的脂質過氧化 (圖7)。和常氧條件相比,缺氧條件下所有載體孵育的細胞均表現出較高的脂質過氧化程度,這與較高的細胞毒性相對應。

圖7. 缺氧敏感高分子膠束可有效誘發腫瘤細胞內脂質過氧化并抑制腫瘤細胞增殖。
最后,研究人員構建了小鼠乳腺癌動物模型,考察了DHM@RSL3高分子膠束對RSL3誘發的腫瘤細胞鐵死亡的增敏作用 (圖8)。通過抑瘤實驗以及對NADPH濃度、GSH含量、Trx含量、GPX4活性等關鍵標記物的分析,驗證了缺氧敏感高分子的體內選擇性鐵死亡增敏作用,為鐵死亡抗腫瘤療法的增效減毒提供了一種新思路。

圖 8. 缺氧敏感高分子膠束的體內抗腫瘤效果評價。
上述成果發表在ACS Nano雜志上,論文題目為“Electron-Accepting Micelles Deplete Reduced Nicotinamide Adenine Dinucleotide Phosphate and Impair Two Antioxidant Cascades for Ferroptosis-Induced Tumor Eradication”。論文的第一作者為天津大學藥學院博士生郭旭亮,通訊作者為趙燕軍教授和王征教授。
論文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.0c00764
- 中科大劉世勇教授課題組《Nat. Chem.》:精準合成高分子單鏈選鍵化學和質譜測序 2022-11-05
- 華東理工大學林嘉平團隊JACS:高分子膠束“平躺”活性生長的新發現 2021-09-08
- 浙江理工大學王新平教授課題組關于三維受限高分子膠束松弛行為研究取得進展 2018-01-16
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
