多項研究表明腫瘤乏氧微環境對于免疫治療具有顯著的抑制效果。近年來以二氧化錳,過氧化氫酶或全氟化碳為代表的納米材料在緩解腫瘤部位的乏氧環境以及提高免疫治療療效方面取得了明顯進展。然而現有的緩解腫瘤乏氧的納米材料往往具有穩定性差,特異性低,產氧效果難以持續等缺點。因此開發一種可特異性在腫瘤部位持續產氧的納米載體對于提高免疫治療效果具有重要意義。
基于納米材料在氧氣遞送上面臨的問題,新加坡國立大學陳小元教授和澳門大學王瑞兵教授課題組聯合設計了一種由乏氧響應聚合物誘導錳鐵氧納米粒組裝形成的中空錳鐵氧納米囊泡。該囊泡可以在腫瘤乏氧微環境中迅速解體釋放包載藥物和錳鐵氧納米粒。前者可以抑制腫瘤生長而后者可以催化腫瘤部位過量的過氧化氫產生氧氣,從而改善腫瘤組織乏氧環境。通過與免疫治療結合該納米囊泡顯示出了良好的化療與免疫治療結合治療效果。
乏氧響應納米囊泡的合成與表征
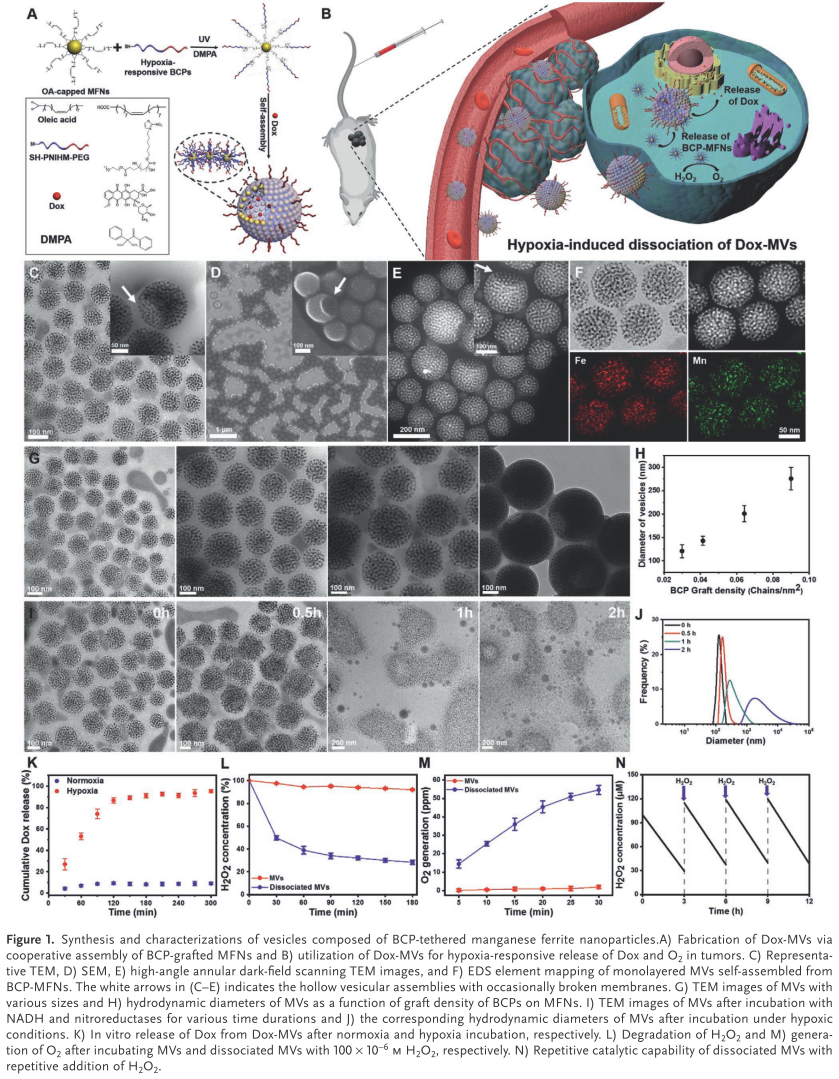
通過SEM,TEM,EDS mapping (C-F)對納米囊泡進行表征證實了納米囊泡的中空結構。通過控制錳鐵氧納米粒表面的兩親聚合物密度可以調控納米囊泡的尺寸(G, H)。在模擬體內乏氧環境中納米囊泡可以迅速解組裝并釋放包載藥物(I-K)。同時釋放出的錳鐵氧納米粒可以快速且持續地催化溶液中的過氧化氫產生氧氣(L-N)。
乏氧響應納米囊泡的細胞吞噬,解組裝與克服乏氧環境
![]()
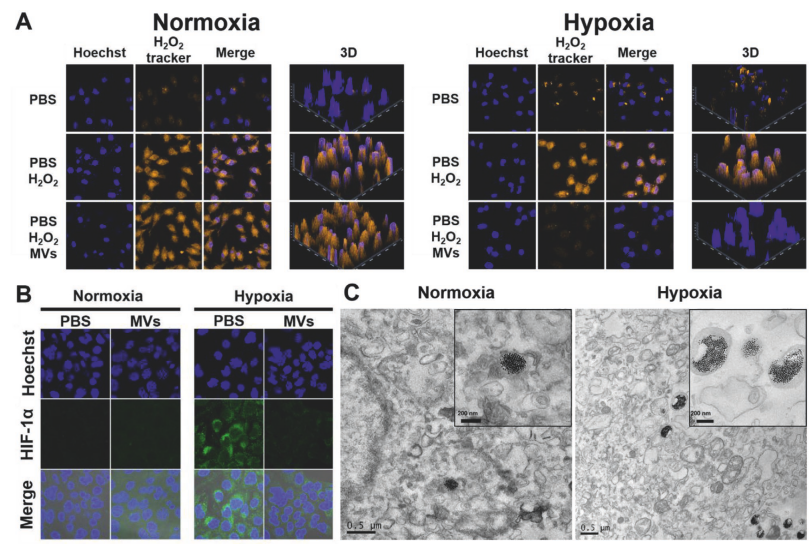
通過過氧化氫探針檢測到在乏氧條件下納米囊泡處理后的細胞內的過氧化氫可以被迅速消耗(A),同時細胞內缺氧誘導因子的表達水平與PBS處理的細胞相比顯著下降(B),表明納米囊泡可以在乏氧環境中于細胞內迅速解體并釋放錳鐵氧納米粒(C),該納米粒可以催化細胞內的過氧化氫產生氧氣改善乏氧環境。
載藥乏氧響應納米囊泡與免疫檢查點抑制劑結合可高效抑制腫瘤生長
![]()
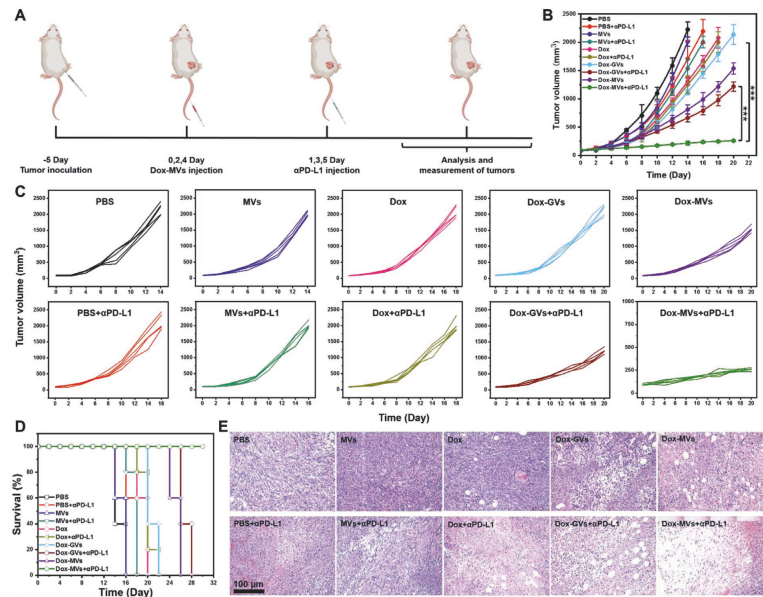
以乳腺癌小鼠為模型研究發現載藥乏氧響應囊泡與免疫檢查點抑制劑結合顯示出了比單一的化學治療或免疫治療更好的腫瘤抑制效果以及更高的小鼠存活率(A-E)。此外通過與無催化產氧能力的載藥金納米囊泡進行對比發現產氧納米載體可以極大地提高免疫檢查點抑制劑對腫瘤的抑制效果。
載藥乏氧響應納米囊泡與免疫檢查點抑制劑結合可有效防止腫瘤轉移與復發
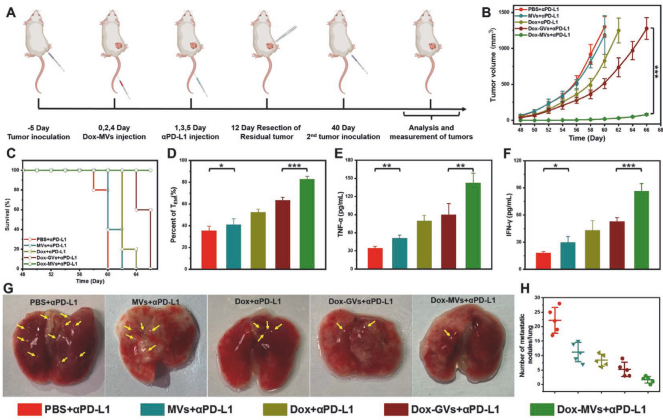

進一步研究發現通過將載藥乏氧響應納米囊泡與免疫檢查點抑制劑結合可以有效激活小鼠體內的記憶T細胞,長時間維持小鼠體內的炎癥因子(如TNF-α和IFN-γ)處于較高濃度,從而抑制小鼠乳腺癌的轉移和復發(A-H)。
此外該納米囊泡還可與其他需要氧氣參與的腫瘤治療方案(如光動力治療,聲動力治療,放射治療等)結合,為今后納米載藥體系的設計提供了新的思路。
以上成果發表于Advanced Functional Materials(Adv. Funct. Mater. 2021, 2008078)上,論文的第一作者為澳門大學濠江學者楊奎琨,共同第一作者為美國國家衛生院學者喻國燦,通訊作者為新加坡國立大學陳小元教授,澳門大學王瑞兵教授和美國國家衛生院鄧宏章博士。
原文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202008078
- 常州大學王建浩教授團隊 IJBM:負載魚腥草囊泡的微環境響應膠原水凝膠治療糖尿病傷口的研究成果 2025-07-14
- 四川大學丁明明教授團隊 Angew: 可視化β折疊到β轉角構象轉變的熒光聚合物囊泡及其用于顏色報告型藥物遞送 2025-07-11
- 中國科大張青川教授、吳尚犬教授團隊 Nano Lett.:通過細胞的“自我激勵”高效生產功能性sEV 2025-05-08
- 四川大學何斌/蒲雨吉 ACS Nano:高分子化丁酸納米平臺治療腸炎 2023-12-24
- 華南理工朱偉 Adv. Sci.:基于紅細胞和MOF-級聯酶的人工生物雜化體用于高尿酸血癥治療 2023-12-17
- 長期有效 | 西南交大周紹兵教授團隊誠招博士、推免碩士 - 材料、生物醫學工程 2023-09-23
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
