糖尿病足潰爛是糖尿病引起的并發癥之一,嚴重影響糖尿病患者的身心健康和生活質量,并增加了患者截肢的風險。過量的炎癥因子和活性氧以及細胞功能的缺失是導致阻礙糖尿病傷口愈合的主要原因。一般來說,炎癥過程出現在傷口愈合過程之前,是整個愈合過程的重要的一部分。但是,在糖尿病慢性傷口環境中,炎癥過程被延長,導致成纖維細胞凋亡,氧化應激失調和活性氧過量。同時,人體自身的抗氧化系統不足以糾正這些由糖尿病引起的功能失調。現階段,用于治療糖尿病傷口修復的生物材料大部分依賴于其裝載的藥物、生長因子或生物活性分子。但是,這些藥物、因子和生物分子價格昂貴,半衰期短,而且容易引起其他副作用。因此,亟需開發一種本征具有調節炎癥和加速傷口愈合能力的生物材料。
針對這一問題,西南交通大學魯雄教授、謝超鳴副教授團隊和四川大學華西口腔醫院王軍教授團隊聯合開發了一種超長導電絲素纖維,并同時用于糖尿病傷口修復和生理信號監測(圖1)。其中,導電絲素纖維通過仿貽貝聚多巴胺(PDA)保護-剝離策略制備得到。在絲素纖維剝離的堿性環境中,由于PDA可快速聚合在剝離的絲素纖維的表面,避免了絲素纖維結構被氫氧根過渡的破壞,使絲素纖維保持了超長的纖維結構(長度達700 μm)。同時,由于絲素纖維表面的PDA,使得導電高分子PEDOT可以均勻組裝在纖維表面,得到仿貽貝導電絲素纖維。最后利用絲素蛋白作為基質,以仿貽貝導電絲素纖維為填料,制備得到了仿貽貝導電絲素纖維貼片。
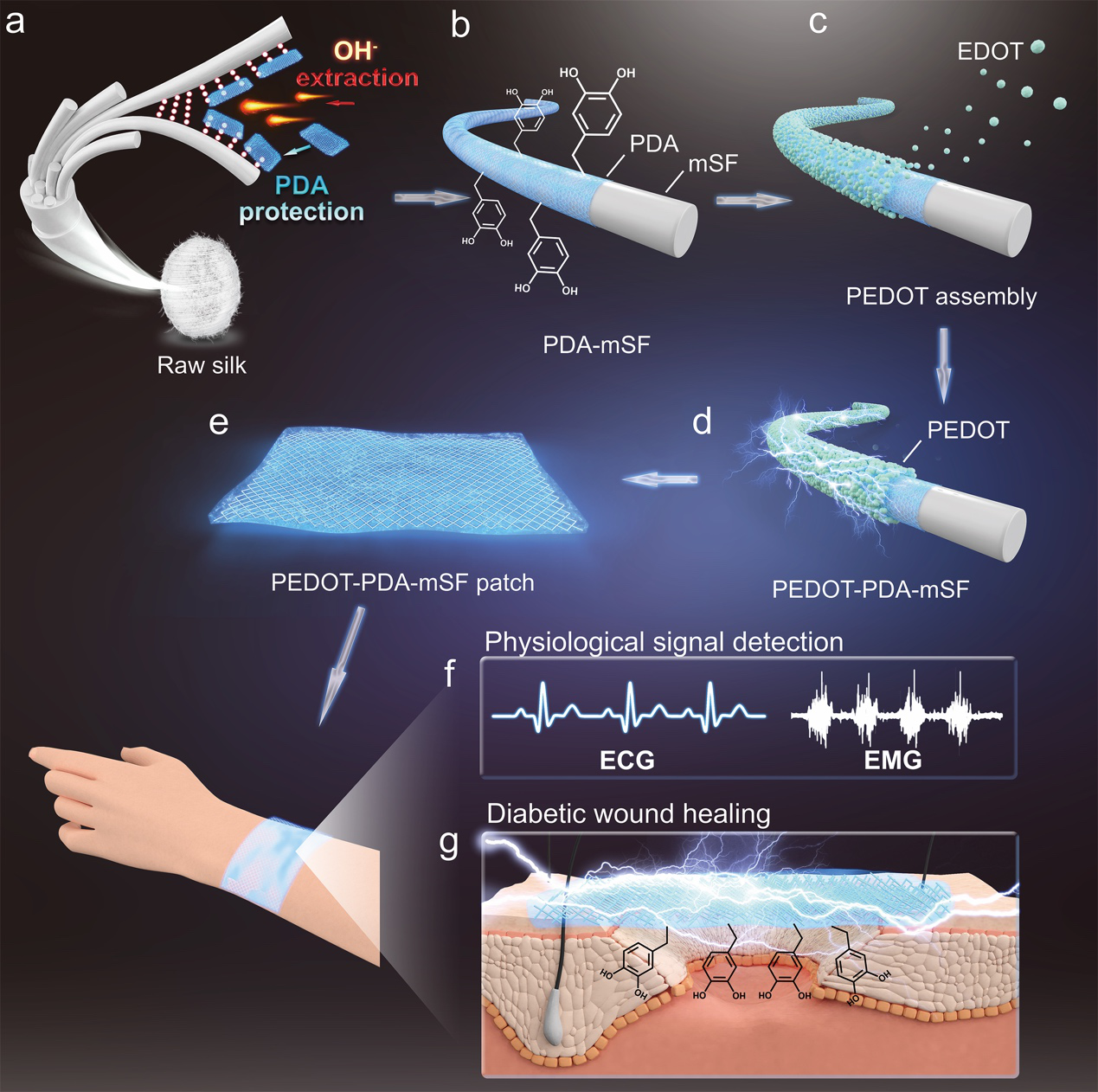
圖1.導電絲素纖維制備過程示意圖。(a)PDA保護-剝離絲素纖維過程。(b)PDA保護的絲素纖維(PDA-mSF)。(c)PEDOT自組裝過程。(d)仿貽貝導電絲素纖維(PEDOT-PDA-mSF)。(e)PEDOT-PDA-mSF貼片。貼片可用于糖尿病病人(f)生理信號實時監測和(g)傷口修復。
該仿貽貝導電絲素纖維貼片能有效改善糖尿病傷口微環境,并加傷口愈合。首先,PDA賦予貼片細胞/組織親和性和粘附性,能促進纖維細胞的粘附和遷移(圖2-1)。其次,貼片的導電性為內源生理電信號的傳輸提供了通路,誘導細胞遷移和定向,并且促進了膠原的沉積和排列(圖2-2)。第三,貼片通過PDA消除自由基的能力降低炎癥因子IL-6和TNF-α的表達減輕了傷口的炎癥反應,從而增加了成纖維細胞的活性,避免了其凋亡(圖2-3)。最后,由于PDA消除自由基的能力,MMP-2和MMP-9的表達被降低,傷口微環境的氧化應激失調得到了有效控制,從而提高了成纖維細胞的活性,調節了膠原沉積和細胞外基質重建(圖2-4)。導電絲素貼片多種優良性能協同地逆轉了糖尿病傷口的微環境,最終導致肉芽組織再生和傷口愈合。不僅如此,由于良好的導電性,該貼片還可以作為柔性電極實時監測病人的生理信號,有望用于診療一體化生物電子。
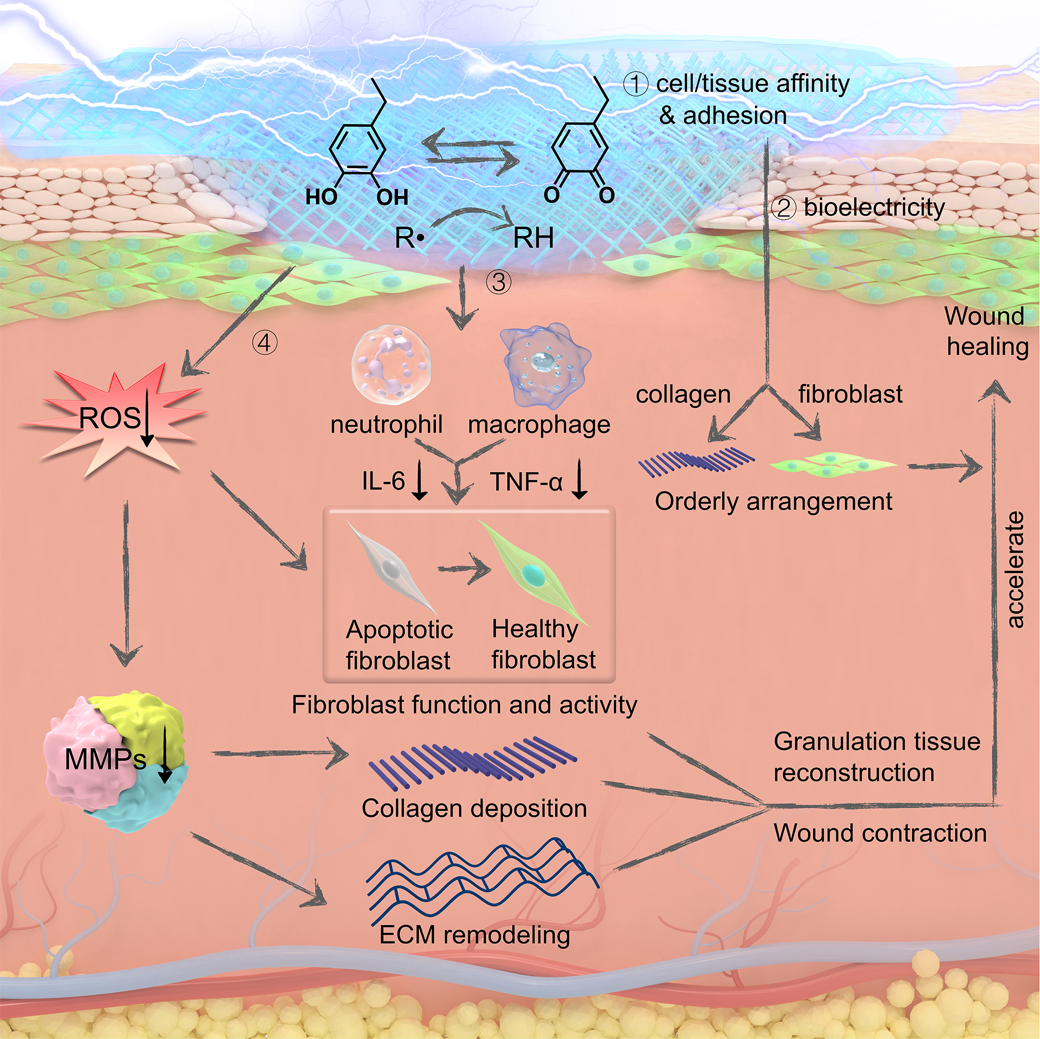
圖2. 仿貽貝導電絲素纖維貼片加速糖尿病傷口修復機理圖。
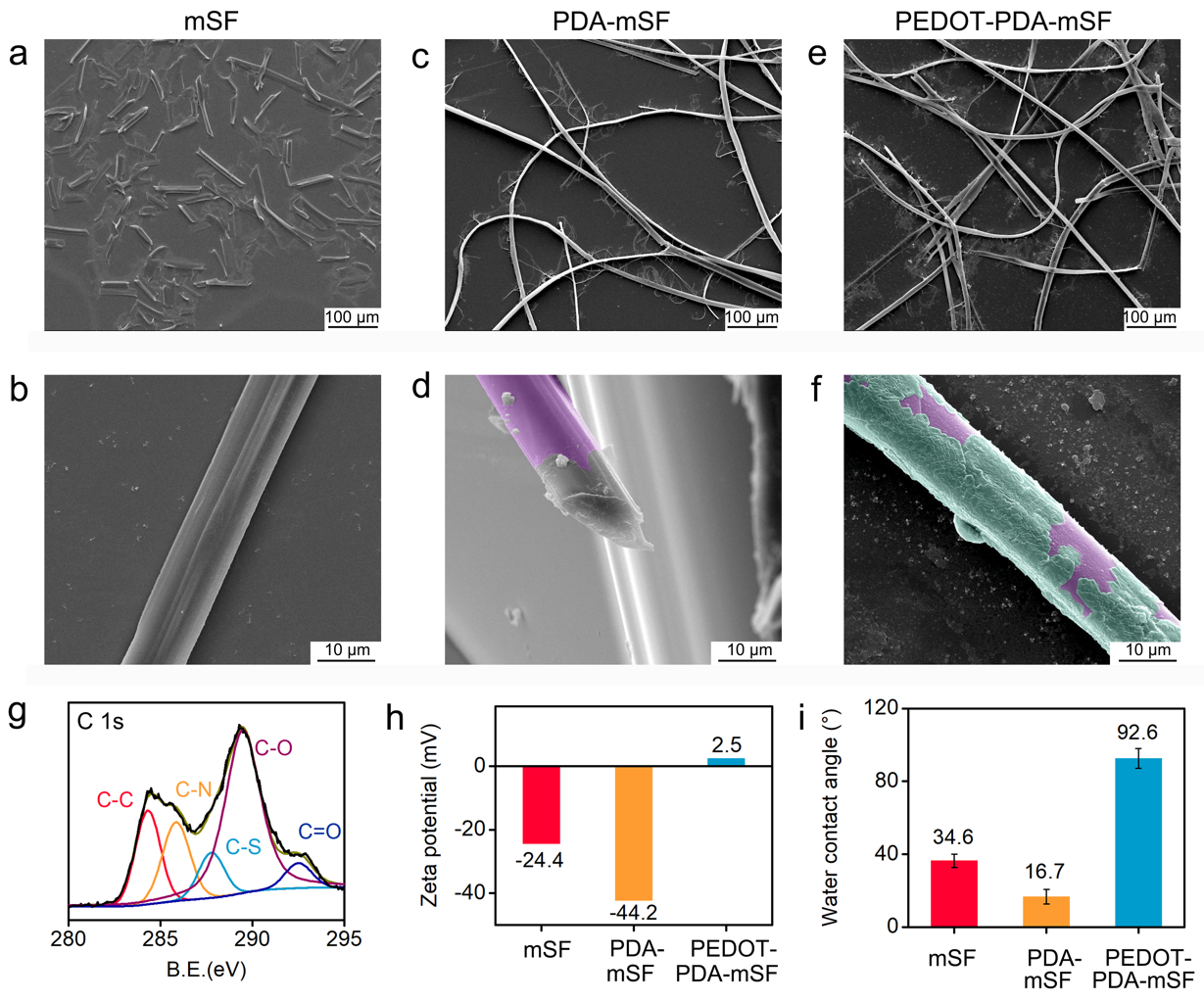
圖3. PEDOT-PDA-mSF的表征。(a-b)傳統堿剝離后的絲素微纖維;(c-d)PDA保護-剝離后的絲素微纖維。粉紅色偽色:PDA;(e-f)PEDOT自組裝在纖維表面。綠色偽色:PEDOT;(g)PEDOT-PDA-mSF纖維的XPS譜圖;(h)不同纖維表面的Zate電位;(i)不同纖維的表面的接觸角。
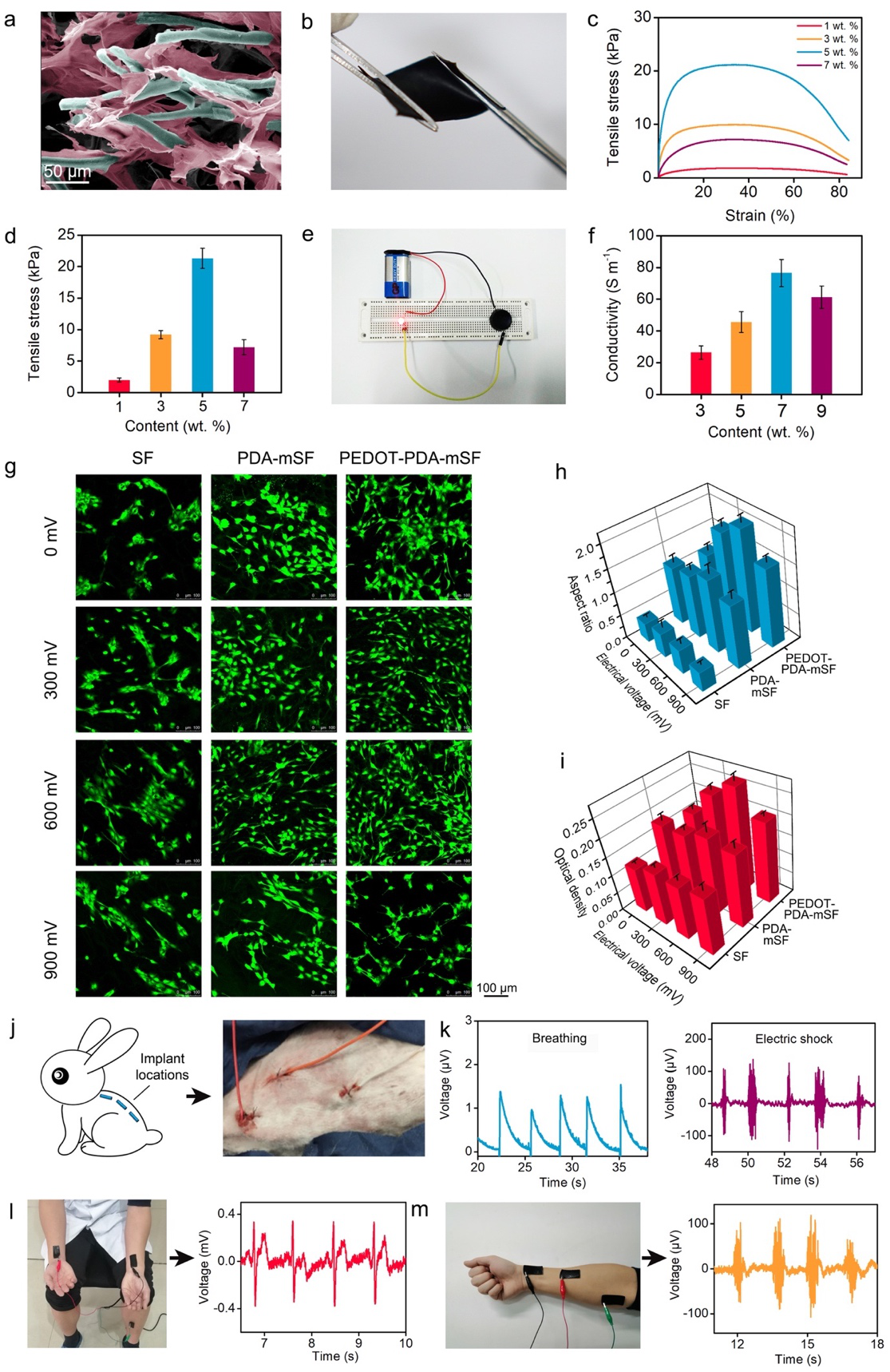
圖4. PEDOT-PDA-mSF纖維貼片的機械性能和導電性。(a)PEDOT-PDA-mSF纖維貼片內部結構的SEM圖片;(b)PEDOT-PDA-mSF纖維貼片的柔韌性展示;(c)不同PEDOT-PDA-mSF纖維的貼片的循環拉伸曲線;(d)不同PEDOT-PDA-mSF纖維的貼片的拉伸強度;(e)PEDOT-PDA-mSF纖維貼片的導電性展示;(f)不同PEDOT-PDA-mSF纖維的貼片的導電性;(g)電刺激下,細胞在PEDOT-PDA-mSF纖維貼片上的熒光照片;(h)電刺激下,細胞在PEDOT-PDA-mSF纖維貼片上的長徑比;(i)電刺激下,細胞在PEDOT-PDA-mSF纖維貼片上的活性;(j-k)PEDOT-PDA-mSF纖維貼片作為植入電極;(l-m)PEDOT-PDA-mSF纖維貼片作為表皮電極。
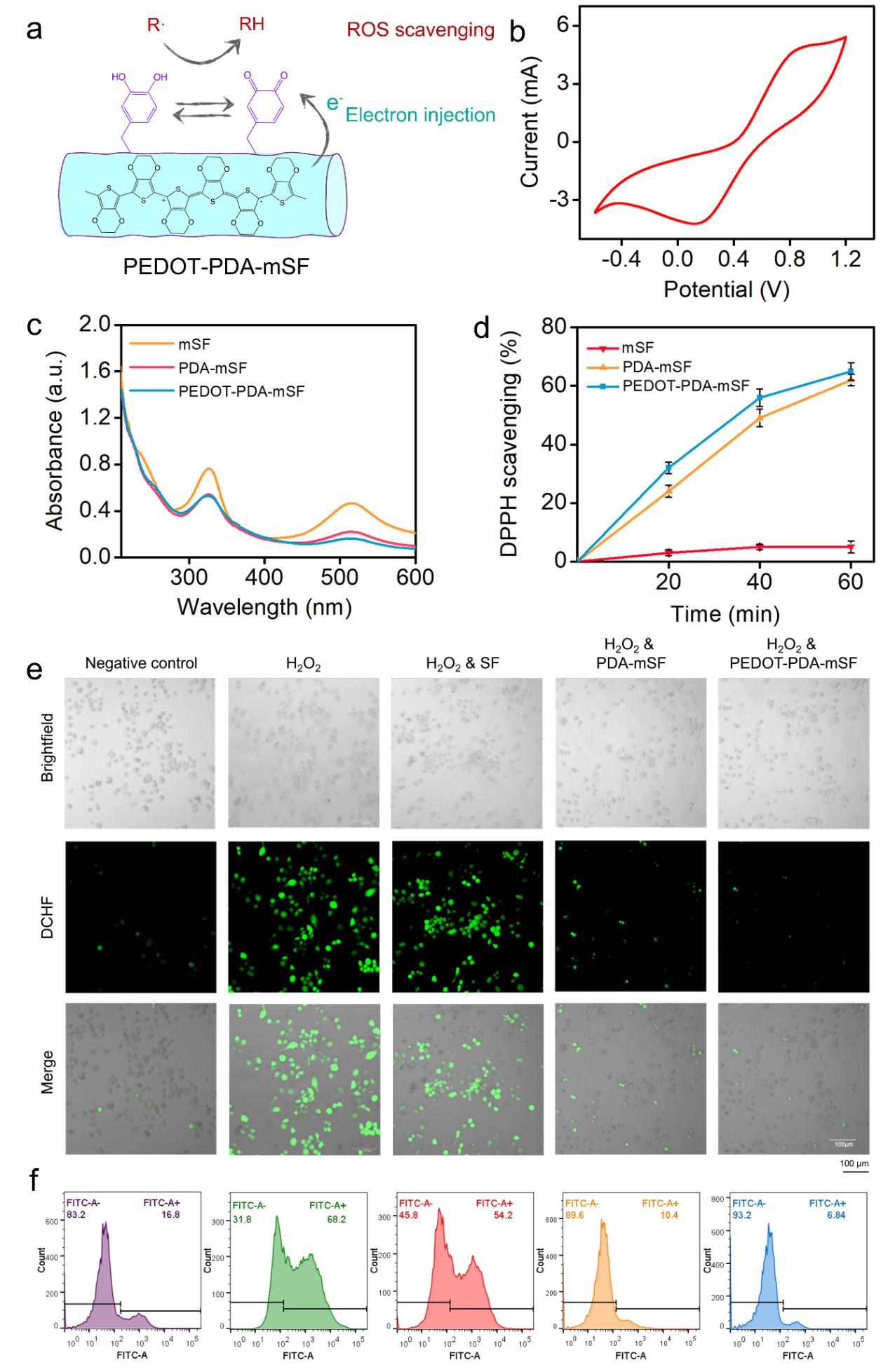
圖5. PEDOT-PDA-mSF纖維貼片的抗氧化能力。(a)PEDOT-PDA-mSF纖維貼片的抗氧化機理;(b)PDA-mSF纖維貼片的CV曲線;(c)不同貼片與DPPH反應后的UV-vis曲線;(d)不同貼片消除ROS的效率;(e)不同貼片細胞內消除ROS的能力評價;(f)不同貼片細胞內消除ROS能力的定量對比。

圖6. PEDOT-PDA-mSF纖維貼片加速糖尿病傷口愈合。(a)不同貼片處理后傷口愈合照片;(b)不同貼片處理后傷口愈合率;(c)處理15天后,傷口部位切片H&E染色;(d)處理15天后,不同組的傷口寬度對比;(e)處理15天后,不同組的新生表皮組織厚度對比。
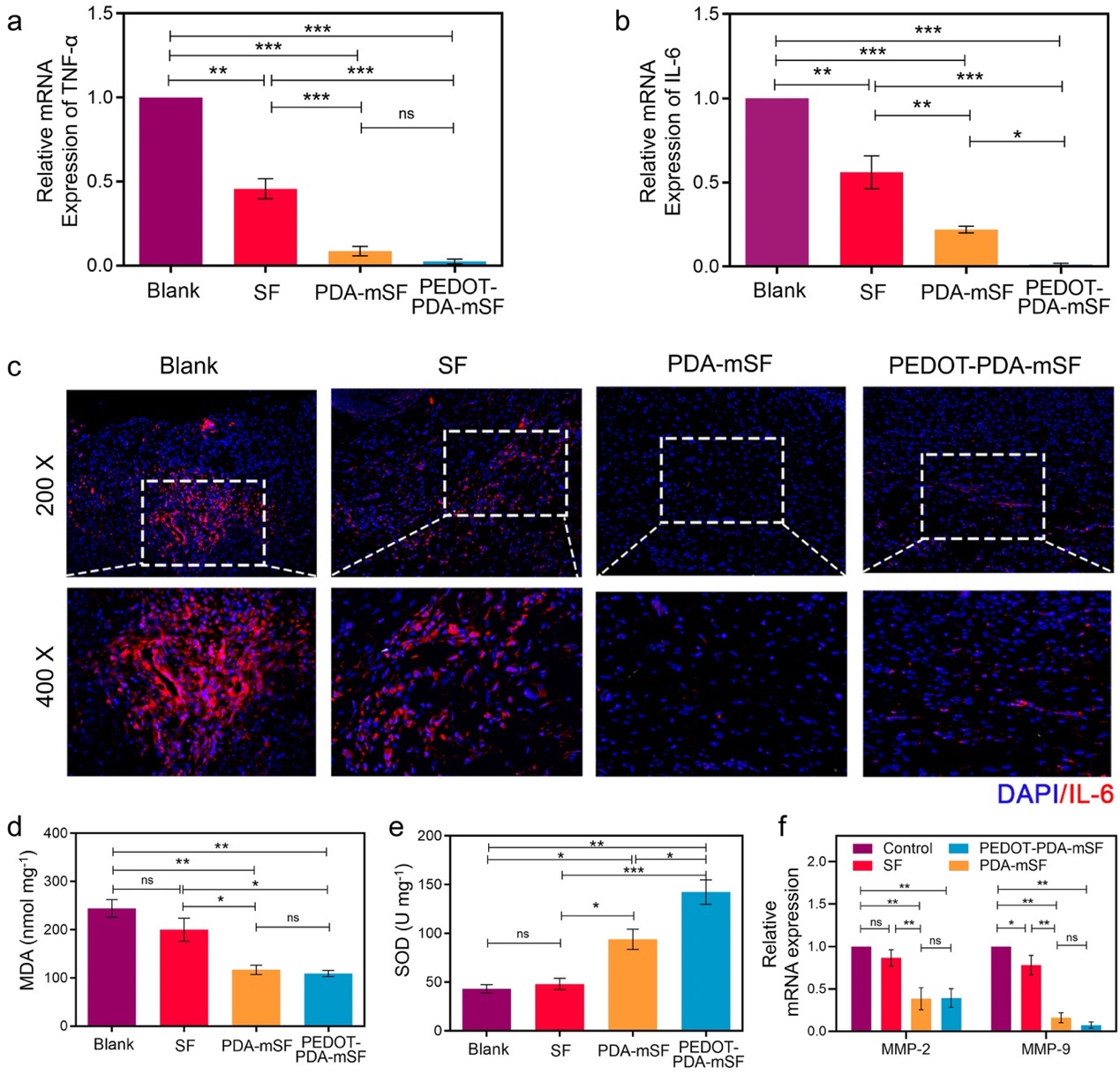
圖7. PEDOT-PDA-mSF纖維貼片減少糖尿病傷口炎癥因子表達和氧化應激。(a)不同組的TNF-α表達;(b)不同組的IL-6 表達;(c)IL-6的免疫熒光染色;(d)不同組的MDA等級;(e)不同組的SOD活性;(f)不同組的MMP-2和MMP-9表達。
該工作以Bioinspired Conductive Silk Microfiber Integrated Bioelectronic for Diagnosis and Wound Healing in Diabetes為題目發表于《Advanced Functional Materials》。論文共同第一作者為西南交通大學材料學院博士生賈占榮、碩士生曾炎和四川大學華西口腔醫學院碩士生鞏靖蕾。西南交通大學魯雄教授、謝超鳴副教授和四川大學華西口腔醫院王軍教授為共同通訊作者。四川大學華西醫院劉瑾副教授為論文的共同作者。
論文鏈接:https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202010461
- 蘭州理工大學冉奮教授團隊 Nat. Commun.:肝素摻雜導電聚合物 2024-12-07
- 西南交大魯雄/中國海大韓璐/北京基礎醫學研究所江小霞等Nano Today:導電粘附水凝膠調控創傷性腦損傷后的神經炎癥與神經功能 2023-07-23
- 北大裴堅教授、王婕妤教授團隊《Sci. Adv.》:單一共軛聚合物實現超高n型和p型導電率和功率因子 2023-03-05
- 青島大學于冰教授團隊 Small:具有快速止血和廣譜抗菌特性的寡肽水凝膠用于加速傷口愈合 2025-06-03
- 川大華西口腔醫學院甘雪琦教授課題組 CEJ: 具有調控免疫反應及促線粒體轉移的新型水凝膠促進糖尿病慢性傷口愈合 2025-05-21
- 福州大學林子俺研究員團隊 AFM:一種具有自氧化特性的鄰位二羥基廣譜抗菌共價有機框架水凝膠用于促進糖尿病傷口愈合 2025-05-06
