側鏈型氨基酸聚合物的組成與結構可設計性強,具有優異的理化性能和良好的細胞相容性,在藥物遞送、手性識別等方面表現出巨大的應用潛力。
北京化工大學王興課題組與新南威爾士大學徐江濤課題組圍繞側鏈型氨基酸聚合物的合成與應用開展了系統的合作研究工作。通過采用光誘導電子/能量轉移可逆加成-斷裂鏈轉移(PET-RAFT)聚合技術,可以高效合成分子量可控、分散性窄(Mw / Mn <1.20)的系列側鏈型氨基酸聚合物(Polymer Chemistry, 2018, 9, 2733–2745);并探究了側鏈型氨基酸聚合物的手性依賴細胞內吞效應 (Colloids and Surfaces B: Biointerfaces, 2021, 202, 111687)。
以此為基礎,兩課題組近日合作報道了可控調節的側鏈型氨基酸嵌段共聚物的自組裝行為。通過調節嵌段共聚物的組成及比例,得到了不同形貌的、由氫鍵和親疏水作用共同調控的自組裝納米結構(圖1),為后續應用研究提供了材料基礎。
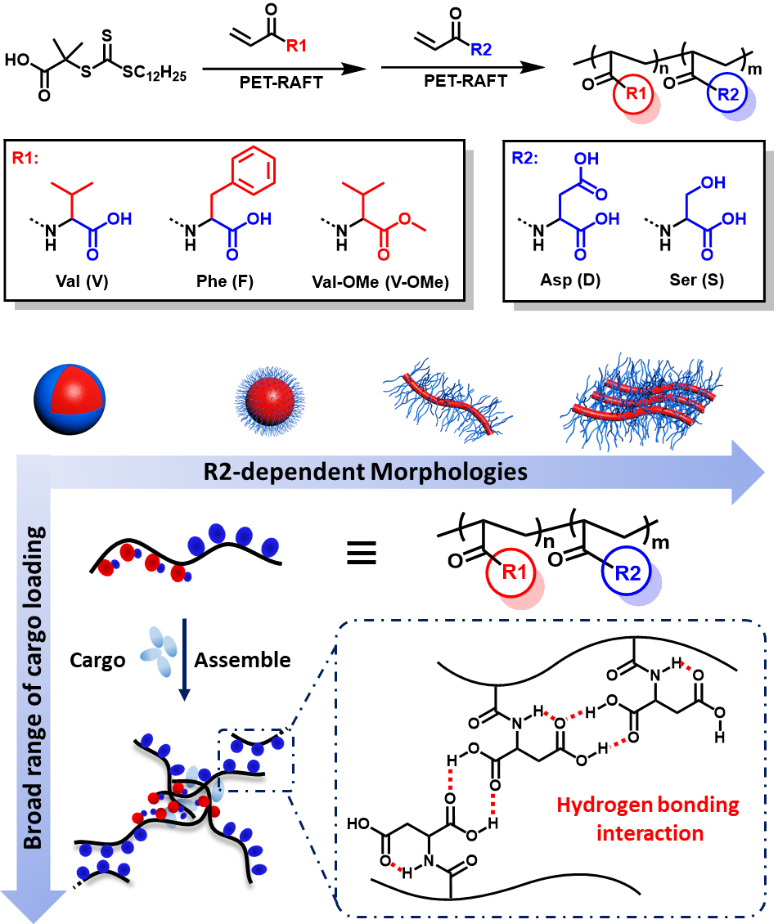
圖1. 側鏈型氨基酸聚合物的設計合成與形貌調控
作者首先選用了N-丙烯酰化纈氨酸(V)作為疏水基元,N-丙烯酰化天冬氨酸(D)作為親水基元,合成了PV-b-PD嵌斷聚合物,并通過自組裝形成納米結構。研究發現,隨著親水鏈段比例增加,PV-b-PD形貌可由球形過渡到纖維及片狀結構(圖2)。
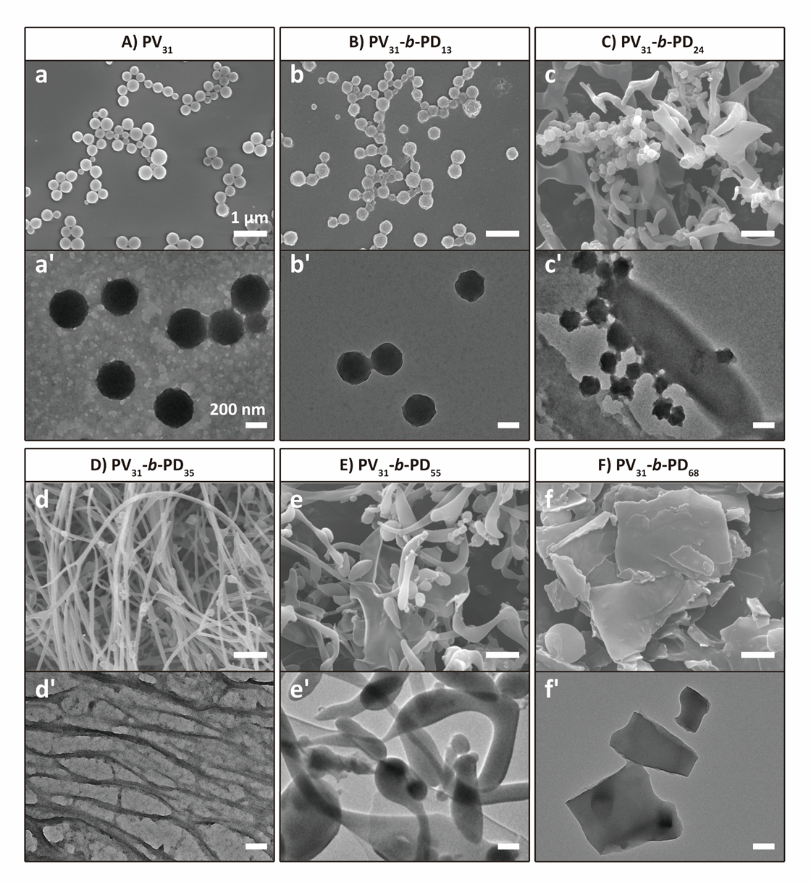
圖2. PV-b-PD自組裝形成的納米結構
為了研究疏水作用對組裝行為的影響,作者選用N-丙烯酰化苯丙氨酸(F)作為疏水基元,合成了PF-b-PD嵌段共聚物(圖3)。與PV-b-PD不同的是,PF-b-PD形成的納米結構經過微球、微球融合到納米纖維的形貌變化。此過程證明疏水作用的增加和π-π堆積可以增強疏水嵌段間的相互作用,在增加親水鏈段的氫鍵作用下,微球逐步融合形成納米結構聚集體;進而由于界面張力,聚集體逐漸形成纖維。

圖3. PF-b-PD自組裝形成的納米結構
為了研究親水作用對組裝行為的影響,作者以PV-b-PD嵌斷聚合物為基準,將疏水鏈段甲酯化,得到PV-OMe-b-PD。研究發現,PV-OMe-b-PD自組裝形成穩定的纖維結構(圖4)。進而以PV-OMe-b-PD為基準,將親水鏈段更換為聚絲氨酸(PS),制備的PV-OMe-b-PS自組裝形成穩定的囊泡結構(圖4)。這主要是由于PD可形成分子間氫鍵,而PS更傾向于形成分子內氫鍵。通過減弱分子間氫鍵相互作用,有利于形成囊泡結構。

圖4. PV-OMe-b-PD和PV-OMe-b-PS自組裝形成的納米結構
最后,作者選取PV-b-PD作為模型聚合物,對具有不同氫鍵受體和供體的藥物進行裝載研究。由于豐富的非共價作用力,PV-b-PD微球載藥率高達21.8%-31.6%,且載藥微球可以在1 min快速內吞進入癌細胞內,釋放藥物,實現良好的抗癌效果(圖5)。

圖5. DOX@NPs快速進入細胞及抗癌效果
側鏈型氨基酸聚合物在生物醫用材料領域具有廣泛的應用前景,該工作通過調控氨基酸種類和比例構建的自組裝形貌庫,為后續開發可控氨基酸聚合物納米材料提供了基礎。
相關研究成果近期以“Self-Assembled Nanosized Vehicles from Amino Acid-Based Amphiphilic Polymers with Pendent Carboxyl Groups for Efficient Drug Delivery”為標題發表在Biomacromolecules雜志上 。本論文第一作者為北京化工大學生命科學與技術學院博士研究生馮文麗。北京化工大學王興教授、李國鋒副教授和新南威爾士大學徐江濤教授為論文的共同通訊作者。該研究得到國家自然科學基金、中央高校基礎研究基金和澳大利亞研究委員會基金的資助與支持。
文章鏈接:https://pubs.acs.org/doi/10.1021/acs.biomac.1c01164
- 蘇州大學張偉教授團隊《Chem. Sci.》: 溶解-聚集和奇偶效應介導的手性轉變和反轉 2023-01-31
- 南京大學諶東中教授課題組:側鏈型盤狀液晶聚合物和聚集誘導發光高分子的間隔基越短越好 2019-04-04
- 華東理工劉潤輝教授課題組 JACS:N-羧基環內酸酐(NCA)開環聚合制備氨基酸聚合物的最新進展及展望 2024-08-23
- 華東理工劉潤輝教授課題組《Adv. Mater.》:多肽模擬聚合物實現內皮細胞選擇性功能 2022-09-02
- 華東理工大學劉潤輝教授課題組在促細胞粘附新材料領域獲得突破:設計和發現雙重機理的促細胞粘附β-氨基酸聚合物 2021-01-26
