
近期,天津大學化工學院仰大勇教授團隊針對腫瘤光動力學治療的應用需求,構建了儲能DNA-長余輝納米復合體,實現了無激發光源的光動力學治療,克服了傳統光動力學療法中激發光組織穿透能力有限的問題。研究成果發表在Advanced Materials,并被選為Editor''s Choice論文。天津大學化工學院趙懷鑫副研究員和碩士研究生李凌慧為共同第一作者,仰大勇教授和李鳳副教授為通訊作者。研究得到國家自然科學基金等資助支持。
近年來,光動力學治療已發展成為一種新型腫瘤治療策略。腫瘤光動力學治療依賴激發光源(通常為長波長激光),組織穿透能力有限,無法實現對深層組織內腫瘤細胞的干預。針對這一問題,亟需發展不依賴激發光源的材料化學系統。長余輝發光材料具有存儲能量的能力,可在無激發光源的條件下持續自行發光;另一方面,DNA具有可編程的分子識別和組裝能力,可實現光敏劑的高效負載和遞送。因此,將長余輝發光材料與DNA材料結合起來形成納米組裝體可為腫瘤光動力學治療提供獨特解決方案。
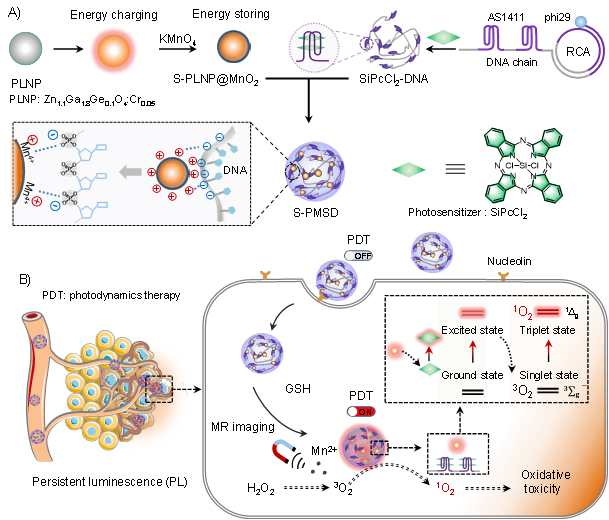
在該研究中,團隊通過對DNA分子序列和長余輝納米粒子(PLNP)的精巧設計,合成了儲能DNA-長余輝納米復合體,在無激發光源的條件下,實現了腫瘤細胞內環境特異性激活的光動力治療。在DNA-長余輝納米復合體中,DNA為滾環擴增合成的長單鏈DNA,DNA鏈中設計有AS1411適配體序列,不僅作為藥物負載模塊實現光敏劑的高效負載,同時作為識別模塊特異性識別癌細胞表面過表達的核仁素受體。納米復合體中,PLNP吸收能量后用二氧化錳外殼進行包封,阻止能量釋放,實現能量的長時間存儲。DNA-長余輝納米復合體識別癌細胞膜上的核仁素,被細胞攝取后,細胞內高濃度的谷胱甘肽使二氧化錳外殼分解,釋放出錳離子和發光PLNP;錳離子催化癌細胞內高濃度H2O2轉變為O2;PLNP釋放出儲存的能量,激發光敏劑,將O2轉化為有毒的1O2,殺死腫瘤細胞。在乳腺癌異種移植小鼠模型中,儲能DNA-長余輝納米復合體在無激發光源的情況下取得了顯著腫瘤生長抑制效果,同時展示出良好的生物安全性。該儲能DNA-長余輝納米復合體提供了一種無需激發光源的新型光動力治療策略,有望促進光動力療法的廣泛應用。
原文鏈接:https://doi.org/10.1002/adma.202109920
- 河北大學張海磊/楊艷民與馬薩諸塞大學韓剛合作再發 Nat. Commun.:在X射線誘導原位合成水凝膠領域取得新進展 2024-04-18
- 港中文(深圳)唐本忠院士/深大熊玉助理教授 AFM:具有寬范圍顏色可調性和持久近紅外發光特性的長余輝發光聚合物材料 2023-12-15
- 港中文(深圳)唐本忠院士/深大熊玉助理教授 AM:基于吡啶取代三苯胺衍生物實現可調諧有機余輝和紫外輻射響應超長室溫磷光 2023-04-10
- 西安工程大學劉呈坤教授團隊 AFMs:具備高靈敏度的仿DNA雙螺旋褶皺柔性纖維力學傳感器用于人體運動監測 2025-05-19
- 喻翠云/魏華團隊 ACS Nano:基于二甲雙胍的多功能納米平臺作為DNA損傷放大器 - 用于最大化放射免疫治療以克服放療耐藥 2025-04-14
- 蘇州大學馮良珠/劉莊教授 Adv. Mater.:構建具有DNA捕獲功能的特洛伊木馬樣錳-殼聚糖微粒用于增效放射免疫聯合治療研究 2025-02-19
- 國科大屈小中教授課題組 Angew:在高分子-蛋白多層次結構納米組裝體制備和應用研究中取得進展 2024-02-27
