生物膜相關手術部位感染(Biofilm-associated surgical site infection,BSSI)是臨床中常見的術后并發癥,約占所有手術部位感染病患的80%,極易導致感染患病率的增加、病程遷延、甚至休克死亡。研究人員嘗試采用諸多方式(例如抑制細菌初始粘附、干擾菌群信號轉導、破壞菌體膜結構等)提高抗生素對BSSI的治療,但獲益十分有限。近年來,載抗生素的微/納米藥物展現出對細菌生物膜的優異治療效果,其通過生物膜微環境響應性(例如酸性、低氧、酶、細菌抗體等)實現對細菌的靶向治療。雖然這些微/納米藥物制劑對體表和淺表細菌生物膜(例如皮膚感染、糖尿病潰瘍創面、眼部感染、口腔感染、骨科植入物感染等)的治療已經取得良好的研究進展,但是對深部BSSI的治療卻療效不佳。BSSI在臨床病患中多為體內深部器質性感染,往往病灶較深同時伴隨著血管密度分布低、血管結構完整、胞外聚合物基質(EPS)致密等特點,使得微/納米藥物難以有效富集和滲透進入深部BSSI,導致反復感染和預后較差。因此,如何增強抗生素在深部BSSI的富集和滲透提高抗菌療效是抗菌微/納米藥物研究中需要解決的難題。
近日,浙江大學黃品同教授、周珠賢教授和南京大學顧寧院士團隊聯合研發了一種胞吞轉運級聯超聲空化的藥物遞送方式,實現對深部BSSI的高效靶向治療。該團隊首先模擬臨床手術過程建立了小鼠深部手術創傷細菌生物膜模型并篩選血管炎性受體,發現血管細胞粘附分子-1 (VCAM1)受體在BSSI病灶血管內皮細胞過度表達,隨即提出構建VCAM1受體介導的胞吞轉運級聯超聲激發的空化爆破效應以連續克服BSSI的血管內皮細胞屏障和EPS基質屏障,提高抗生素藥物在BSSI的高效富集和深部滲透,實現對細菌生物膜的徹底清除。
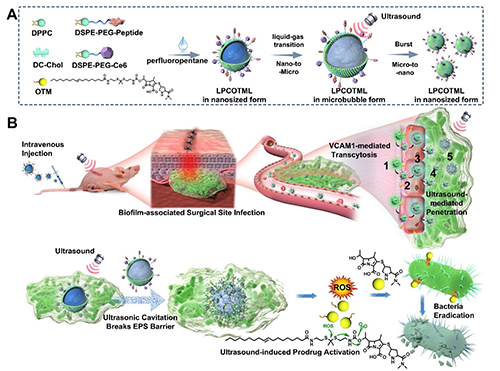
圖1. LPCOTML的構建和對BSSI靶向治療的機制示意圖。
實驗結果顯示:LPCOTML脂質體具有良好的藥劑學穩定性、規模化制備重復性和超聲刺激響應前藥激活及釋藥特性;LPCOTML通過胞膜窖介導的胞吞和胞吐作用,實現在過表達VCAM1的血管內皮細胞中快速跨細胞轉運;LPCOTML在超聲輻照下,劇烈爆破EPS基質,使藥物能夠深部滲透分布整個細菌生物膜組織;LPCOTML在體外和體內均展現出抑制銅綠假單胞菌生物膜的顯著療效,比原藥美羅培南和同類對照制劑高出數10倍的抑制效率;在深部BSSI動物模型治療中,LPCOTML能夠高效根除銅綠假單胞菌生物膜,60%以上的小鼠被完全治愈,顯著優于臨床制劑美羅培南、慶大霉素和Amikacin脂質體的抗菌效果。
參考文獻:Guowei Wang, Chengyue Zhang, Zixuan Huang, Jifan Chen, Hongjian Chen, Tao Lin, Zhuxian Zhou, Ning Gu, and Pintong Huang. Transcytosable and Ultrasound-Activated Liposome Enables Deep Penetration of Biofilm for Surgical Site Infection Management, 2024, 2411092.
原文鏈接:https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202411092
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統"降尿酸-抗炎-消化系統保護"三位一體協同用于痛風性關節炎的治療 2025-06-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
- 四川大學鄧怡團隊《ACS Nano》:多功能納米生物異質結復合水凝膠敷料 - 用于傷口細菌生物膜感染的診療一體化新策略 2025-03-15
- 港中大張立教授團隊《Sci. Adv.》:液態機器人清除復雜表面細菌生物膜 2025-03-15
- 北化徐福建/趙娜娜教授團隊 Nat. Commun.:靶向胞外聚合物基質的Janus納米顆粒用于靈活清除耐藥細菌生物膜 2023-08-26
