化療因其無創(chuàng)傷性、普遍性和全身治療性,一直是腫瘤臨床治療的主要方式之一。但化療藥物通常具有疏水性、不穩(wěn)定性、藥代動力學差、生物利用度低、非靶向特異性等特點,從而導致治療效果不理想和全身毒副作用。同時,單一化療難以應對腫瘤的復雜性和異質(zhì)性,易導致腫瘤耐藥和復發(fā)。目前,提高化療療效主要有兩種策略:一方面,開發(fā)納米級給藥系統(tǒng),在腫瘤部位富集藥物,從而降低對正常組織的毒性,提高抗腫瘤療效;另一方面,通過雙藥/多藥介導的聯(lián)合化療或化療與其他治療方式的協(xié)同,顯著提高腫瘤治療效果。
化學動力學療法(CDT)在腫瘤特異性治療中具有優(yōu)勢。同時,CDT可破壞癌細胞的氧化還原平衡,降低其抗氧化能力,從而增加癌細胞對化療藥物的敏感性。過渡金屬離子可與腫瘤微環(huán)境(TME)中的過氧化氫(H2O2)發(fā)生芬頓或類芬頓反應生成劇毒的羥基自由基(×OH),通過CDT誘導癌細胞凋亡。特別是,鐵離子(Fe3+)可消耗TME中的谷胱甘肽(GSH),并產(chǎn)生亞鐵離子(Fe2+)。Fe3+和生成的Fe2+都會進一步與TME中的H2O2反應生成×OH,從而降低抗氧化能力,并增強癌細胞的CDT。有趣的是,Fe3+介導的GSH氧化和Fe2+介導的芬頓反應的聯(lián)合可以在Fe3+和Fe2+之間形成了一個循環(huán),持續(xù)消耗GSH并產(chǎn)生活性氧(ROS),從而增強癌癥治療效果。
棉酚(Gos)是一種天然多酚化合物,因其強大的抗腫瘤活性而被視為一種潛在的化療藥物。Gos不僅能引起線粒體功能障礙,還能直接與抗凋亡蛋白Bcl-2結(jié)合,抵消其抗凋亡作用,從而引發(fā)癌細胞凋亡。與正常細胞不同,癌細胞受到持續(xù)的氧化應激(OS)和內(nèi)質(zhì)網(wǎng)應激(ERS)的影響。因此,Gos介導的化療和ROS依賴性CDT的協(xié)同治療有望放大OS,從而提高治療效果。此外,IRE1a-X-box結(jié)合蛋白1(XBP1)作為ERS的關鍵傳感器和反應器,被研究用于促進腫瘤治療。即癌細胞能激活IRE1a來剪接XBP1并形成剪接的XBP1(XBP1s),從而適應ERS并存活下來。作為一種天然腺苷類似物,豐加霉素(Toy)能夠阻斷IRE1a-XBP1通路來加劇ERS并誘導癌細胞凋亡,從而顯示出良好的抗腫瘤活性。因此,將Gos誘導的線粒體功能障礙和ROS生成、Toy加劇的ERS和Fe3+介導的CDT整合在一起,有望為高效治療腫瘤提供一種充滿前景的方法。
“All-in -one”納米平臺已經(jīng)被用于有效遞送化療藥物。然而,輔料或載體帶來的低藥物負載率、免疫原性和毒性等挑戰(zhàn)對納米藥物的臨床轉(zhuǎn)化構成了重大障礙。有趣的是,通過活性成分自組裝構建的無載體全活性納米平臺具有巨大的優(yōu)勢,包括改善藥物輸送、增強腫瘤治療效果和減少毒副作用。最近,由金屬離子和多酚化合物自組裝而成的金屬酚類納米材料正在成為一種全活性納米藥物,并具有良好的抗腫瘤效果和臨床轉(zhuǎn)化潛力。特別是Fe3+很容易與多酚化合物配位自組裝形成金屬酚納米材料,受益于Fe3+的高r1弛豫率和芬頓反應的催化活性,其T1MR成像和CDT療效極佳。因此,將Gos、Fe3+和Toy自組裝成金屬酚納米藥物有望促進高效精準的腫瘤治療。
此外,單獨化療或CDT已被證實可誘導免疫原性細胞死亡(ICD)以激活抗腫瘤免疫響應,因為發(fā)生ICD的腫瘤細胞可釋放損傷相關分子模式(DAMPs)使樹突狀細胞(DCs)成熟,從而激活細胞毒性T淋巴細胞。然而,腫瘤細胞表面表達的程序性細胞死亡配體1(PD-L1)會通過逃避免疫監(jiān)視而導致T細胞失活或衰竭。為應對這一問題,PD-L1抗體(A-PD-L1)已被用于通過免疫檢查點阻斷(ICB)恢復T細胞的活性,從而激活全身性抗腫瘤免疫。

圖1. GFT NCs的微流控合成及其腫瘤診療應用示意圖。
顯然,納米藥物的可重復性制備和均一理化特性是其臨床轉(zhuǎn)化的關鍵因素。 然而,傳統(tǒng)的濕化學合成方法由于無法精確控制合成過程,往往難以制備出具有良好均一性和穩(wěn)定性的高質(zhì)量納米藥物,而微流控技術由于能夠通過控制反應流體、流量比(FRR)和反應動力學來精確控制納米平臺的粒度、形態(tài)和組分,因此在制備高質(zhì)量納米材料方面具有極大的優(yōu)越性。因此,采用微流控技術制備一系列基于金屬有機框架、脂質(zhì)、凝膠和礦化腫瘤細胞的高質(zhì)量納米藥物用于癌癥治療至關重要。此外,S形通道還有助于流體的充分混合。因此,微流體技術有望實現(xiàn)一步可控制備全活性金屬酚納米藥物。

圖2. GFT NCs的表征。(A)GFT NCs的TEM圖像;(B)GFT NCs的水合粒徑和電勢;Gos、Toy和GFT NCs的紫外圖譜(C)和紅外圖譜(D);GFT NCs的XPS圖譜(E)和高分辨率Fe 2p XPS圖譜(F);GFT NCs在不同pHs磷酸鹽緩沖液中Gos(G)、Fe3+(H)和Toy(I)的釋放曲線。

圖3. GFT NCs介導的ROS產(chǎn)生、誘導的線粒體功能障礙和加劇的ERS。(A)不同Gos或Toy濃度的Gos、Toy、GT或GFT NCs處理24 h后4T1細胞的活力;(B)不同Fe3+濃度的Fe3+、TF、GF或GFT NCs處理24 h后4T1細胞的活力;不同處理后,4T1細胞內(nèi)ROS(C)和GSH(D)的含量;(E)不同處理后,4T1細胞內(nèi)LPO的積累(細胞核:藍色,氧化態(tài)C11-BODIPY581/591:綠色,和非氧化態(tài)C11-BODIPY581/591:紅色);(F)GFT NCs誘導線粒體功能障礙和加劇ERS的示意圖;(G)不同處理6 h后,4T1細胞內(nèi)線粒體膜電位變化情況;(H)不同處理24 h后,4T1 細胞內(nèi)質(zhì)網(wǎng)應激相關蛋白GRP78、p-IRE1a、XBP1u、XBP1s和CHOP的蛋白質(zhì)印跡分析。
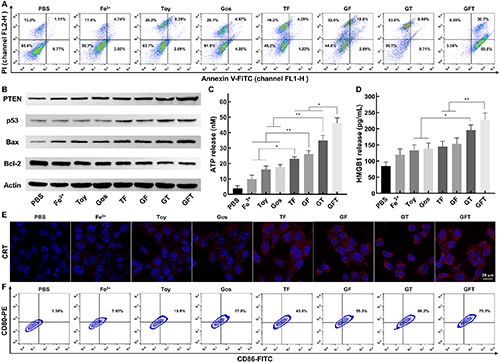
圖4. GFT NCs體外誘導ICD和DCs成熟。(A)不同處理6 h后,4T1細胞凋亡情況;(B)不同處理24 h后,4T1細胞凋亡相關蛋白表達結(jié)果;不同處理24 h后,4T1細胞釋放ATP的水平(C)、HMGB1的水平(D)和4T1細胞膜表面暴露CRT的水平(E);(F)不同處理24 h后的4T1細胞和iDCs共培養(yǎng)24 h后,DC成熟情況的流式細胞術分析。
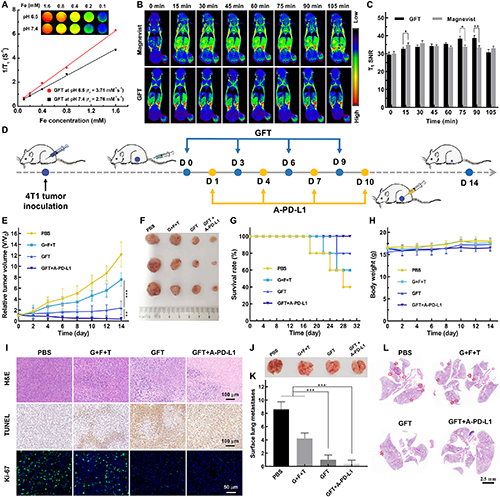
圖5. GFT NCs用于4T1腫瘤的MR成像和治療。(A)GFT NCs在不同pH條件下的T1 MR成像以及r1弛豫率;尾靜脈注射GFT NCs或Magnevist([Fe] = 0.4 mg×mL-1,[Gd] = 0.4 mg×mL-1,100 mL PBS/每只小鼠)前后不同時間點腫瘤的活體T1加權MR圖像(B)及對應的信噪比(SNR)(C);(D)GFT+A-PD-L1的體內(nèi)聯(lián)合治療示意圖;不同治療14天后,小鼠的相對腫瘤體積變化曲線(E)和腫瘤代表性照片(F);不同治療30天后,小鼠的生存率變化曲線(G)和不同治療14天后小鼠的相對體重變化曲線(H);(I)不同治療14天后,小鼠腫瘤組織切片的H&E、TUNEL和Ki-67染色情況;不同治療14天后,小鼠肺的代表性照片(J)、肺轉(zhuǎn)移腫瘤結(jié)節(jié)定量分析(K)和肺組織切片的H&E染色情況(L)。
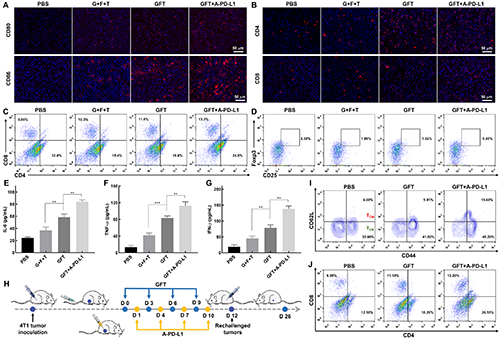
圖6. GFT NCs聯(lián)合A-PD-L1的抗腫瘤免疫應答和腫瘤特異性免疫記憶效應。不同治療14天后,小鼠腫瘤組織切片的CD80+和CD86+ DCs的免疫熒光染色情況(A)、CD4+ T細胞和CD8+ T細胞的免疫熒光染色情況(B),小鼠腫瘤部位的CD4+ T細胞和CD8+ T細胞的比例(C)、免疫抑制Tregs(CD4+CD25+Foxp3+ T 細胞)的比例(D),小鼠血清中IL-6(E)、TNF-a(F)和IFN-g(G)的細胞因子水平;(H)免疫記憶效應的驗證示意圖;(I)不同治療11天后小鼠脾臟中TCM(CD44+CD62L+ T細胞,門控CD8+ T細胞)和TEM(CD44+CD62L-T細胞,門控CD8+ T細胞)的比例;(J)不同治療26天后,小鼠再挑戰(zhàn)腫瘤中CD4+/CD8+ T細胞的比例。
簡言之,該研究設計的GFT納米藥物的主要優(yōu)勢在于以下幾個方面:1)通過一步微流控法制備得到高質(zhì)量的無載體全活性GFT NCs,可在T1 MR成像引導下將Gos、Fe3+和Toy共同遞送至腫瘤部位;2)Gos誘導的線粒體功能障礙、Toy加劇的ERS和Fe3+介導的CDT相結(jié)合,放大了ICD效應,產(chǎn)生了全身抗腫瘤免疫;3)GFT NCs聯(lián)合A-PD-L1,可通過重塑腫瘤免疫微環(huán)境和長期腫瘤特異性免疫記憶作用,高效治療腫瘤并抑制腫瘤轉(zhuǎn)移和復發(fā)。
文章鏈接:https://doi.org/10.1002/adfm.202417070
- 東華大學史向陽教授團隊:微流控合成纖連蛋白包覆的聚多巴胺納米復合物用于自補充腫瘤微環(huán)境調(diào)節(jié)和MR成像引導下的三模態(tài)聯(lián)合治療 2023-06-01
- 東華大學史向陽教授團隊 Nano Today:微流控合成腫瘤微環(huán)境調(diào)控型超小氧化鐵納米團簇用于動態(tài)MR成像導引的腫瘤聯(lián)合治療 2022-09-17
- 四川大學高會樂教授課題組 AFM:二甲雙胍介導的空間特異性多響應無載體自組裝納米遞藥系統(tǒng)聯(lián)合化療重塑免疫抑制微環(huán)境 2024-02-21
- 中科院納米能源所李琳琳團隊 JACS:具有動態(tài)活性位點的Ga/Zn雙單原子納米酶提高癌癥治療 2025-05-10
- 維生素C變身抗腫瘤“特洛伊木馬”!中科大李敏/王育才團隊 ACS Nano:揭秘VC如何“里應外合”擊潰腫瘤防線 2025-03-29
- 東華大學史向陽教授/沈明武研究員團隊 AFM: 雙驅(qū)動納米馬達用于高效腫瘤光熱治療及治療后炎癥緩解 2025-03-17
- 東華大學史向陽/沈明武團隊 Acta Biomater.:仿生含銅納米凝膠用于磁共振成像引導的腫瘤化療-化學動力學治療-免疫治療 2024-10-03
