光動力治療以其創傷小、操作簡單等優點正在成為腫瘤治療的重要手段之一,通常用于治療癌前期皮膚病和皮膚惡性腫瘤,如日光性角化病、基底細胞癌、鱗癌等,也可用于血管畸形、尋常痤瘡等非惡性腫瘤性皮膚病的治療中。
近日,南開大學化學學院郭東升教授團隊、生命科學學院丁丹教授團隊聯合研究開發了“可激活”納米藥物,克服了傳統光敏劑缺乏腫瘤靶向性,對正常組織具有光毒性等不足,降低其光毒性并提高治療效果,且能夠實現診療一體化。該策略已經成功應用于活體動物實驗,為腫瘤等疾病的臨床精準治療提供新方法。相關成果發表于《美國化學會志》(J. Am. Chem. Soc., 2018, DOI: 10.1021/jacs.8b02331)。
光動力治療,需要將光敏劑輸入人體,在一定時間后,以特定波長的光照射病變部位,通過一系列光物理和光化學過程,使異常增生活躍的細胞發生不可逆的損傷,最終使細胞死亡,達到治療目的。而傳統光敏劑,對正常組織具有光毒性,使其在臨床應用中受到極大限制。如何改良現有商業化光敏劑,是一個極具挑戰性的難題。近年來,“可激活”光敏劑用于光動力治療備受科研人員的關注。
郭東升教授課題組在基于杯芳烴的超分子診療學方面做了一系列研究工作。郭東升教授介紹:“杯芳烴的分子結構,就像是一個口袋,可以有效包載染料分子并對其光物理性質進行調控,對于腫瘤標志物進行特異性響應,更為重要的是兩親性杯芳烴可以方便地自組裝形成納米藥物載體。”同時他們也在思考如何將杯芳烴作為納米藥物的智能模塊,實現腫瘤選擇性成像和靶向治療。
為了解決這個關鍵科學問題,郭東升教授課題組提出了“生物標志物置換激活”的新策略。從已經成熟的商業化光敏劑出發,采用兩親性杯芳烴與光敏劑結合,通過主客體相互作用,構筑納米超分子藥物——被杯芳烴“口袋”包封的光敏劑。相對于共價修飾改良光敏劑的方法,此次研發的新策略優勢明顯:直接使用商業化光敏劑,避免繁瑣的合成與分離;光敏劑被“無痕”釋放,其光物理性質保持高保真度;杯芳烴兩親組裝體作為載藥平臺具有通用性,可根據實際需要靈活選擇多種光敏劑與之適配。
為驗證此策略可行性,郭東升教授課題組設計構筑了兩親杯芳烴的納米藥物載體,選擇4種代表性的商用光敏劑為模型藥物,腫瘤標志物鎖定為三磷酸腺苷即ATP,當光敏劑被裝進杯芳烴“口袋”后,其熒光和光活性被完全淬滅;當ATP濃度為腫瘤濃度時,光敏劑被“激活”了,熒光和光活性幾乎完全恢復;而正常組織的ATP濃度并不能造成光敏劑的釋放。
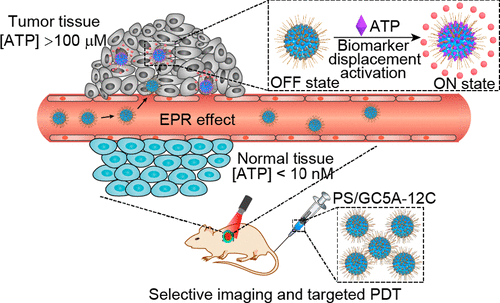
圖1 “生物標志物置換激活”策略示意圖
在化學理論上得到驗證后,丁丹教授課題組成功將該策略應用于活體腫瘤成像和治療。丁丹教授介紹:“當光敏劑被包結在主體空腔內時,其熒光成像能力和光活性幾乎被完全淬滅,因此光敏劑在藥物遞送過程中處于一種‘靜默’狀態;當納米藥物被運送到腫瘤組織區域時,腫瘤內過表達的生物標志物會與主體結合,光敏劑被置換出空腔,重新激活其原有光物理性質,從而實現腫瘤選擇性成像和靶向治療。”
進而,丁丹教授課題組將基于此策略的納米藥物拓展到活體抗腫瘤研究。他們將負載光敏劑的納米藥物通過尾靜脈給藥的方式注射入荷瘤裸鼠體內,然后進行實時熒光成像,納米藥物能夠在腫瘤部位靶向釋放光敏劑,達到了對腫瘤選擇性成像的目的。根據活體成像結果,選擇最佳治療時間點進行光動力治療,結果表明相對于單獨的商用光敏劑,這種可激活的智能納米藥物具有準確的靶向性和優越的抗腫瘤效果。
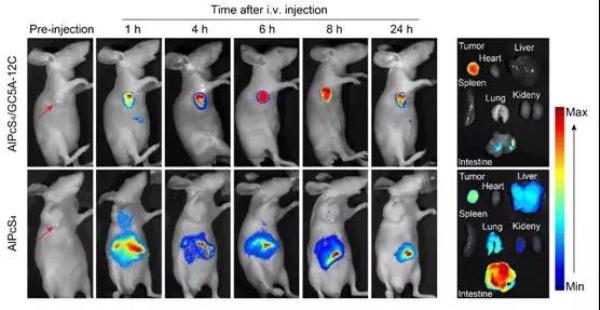
圖2 基于“生物標志物置換激活”策略的納米藥物活體腫瘤靶向成像效果
郭東升教授、丁丹教授課題組基于主客體化學理念提出了新穎的策略,實現了腫瘤選擇性成像和靶向治療。通過精心設計杯芳烴主體結構,借助其優良的識別和組裝性質,構筑了診療一體化的納米藥物,并成功應用于活體抗腫瘤中。這一開創性工作為實現精準醫療提供了新方法,發展了新材料。
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內遞送 2025-05-03
- 川大李旭東/陳君澤、港城大譚超良團隊 Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續流生產 2025-02-12
- 天工大高輝/李曉暉團隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導的結直腸癌化療耐藥與免疫抑制 2025-02-11
- 東南大學葛麗芹教授課題組《ACS AMI》:微波響應工程化血小板微針貼片用于腫瘤深層滲透和精準治療 2025-02-26
- 澳門大學王瑞兵團隊 JACS: 乏氧誘導的超分子自由基實現胞內聚合介導的腫瘤精準治療 2025-01-15
- 無線植入設備實現腦腫瘤精準治療 - 中山大學徐炳哲團隊突破膠質瘤治療難題 2024-12-15
- 東華大學郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環境調控光熱/催化療法 2025-06-19
