光動力治療(PDT)是利用激光照射光敏劑后產生具有較強殺滅作用的活性氧(ROS)從而殺傷腫瘤細胞的治療方法;同時,PDT治療后,腫瘤細胞的碎片會產生少量的腫瘤相關抗原,從而激發抗腫瘤免疫效應。然而,腫瘤微環境通常處于乏氧狀態,限制了ROS的有效產生;并且PDT治療產生的免疫效應不足以有效清除殘余腫瘤細胞并抑制轉移。因此,持續改善腫瘤微環境乏氧狀態、提高免疫系統的應答效率,開發有效的PDT/免疫聯合治療方法在腫瘤治療領域具有重要意義。
可注射水凝膠能有效包覆生物活性物質并以溶液的形式注射到病灶部位,通過內源刺激(如pH、氧化還原、和酶)或外部刺激(如光)將其轉化為凝膠。其中,光引發原位聚合水膠凝體系其時空控制精度高,可操作性更強而備受關注。然而,該體系大多數是由對組織穿透深度有限的短波長光(如紫外光)作為光源。雖然PDT過程可以產生單線態氧(1O2)和自由基等ROS,但利用PDT過程中產生的自由基引發水凝膠聚合的策略卻鮮有報道。
近期,蘇州大學劉莊教授研究團隊提出了一種全新的體內水凝膠可控制備和腫瘤PDT/免疫聯合治療方法:通過將光敏劑Chlorin e6(Ce6)與過氧化氫酶(CAT)結合,獲得一種復合光敏劑(Ce6-CAT);隨后,將Ce6-CAT與聚乙二醇雙丙烯酸酯(PEGDA)混合獲得可注射水凝膠前驅體,并在前驅體中加入imiquimod(R837)作為免疫佐劑;將可注射水凝膠前驅體注射到腫瘤病灶處,并采用660 nm的光進行照射,Ce6產生的自由基可引發PEGDA的發生聚合而原位形成水凝膠;同時,光照產生的ROS對腫瘤細胞具有較強的殺傷作用,可以對腫瘤進行長期的光動力治療,如圖1所示。
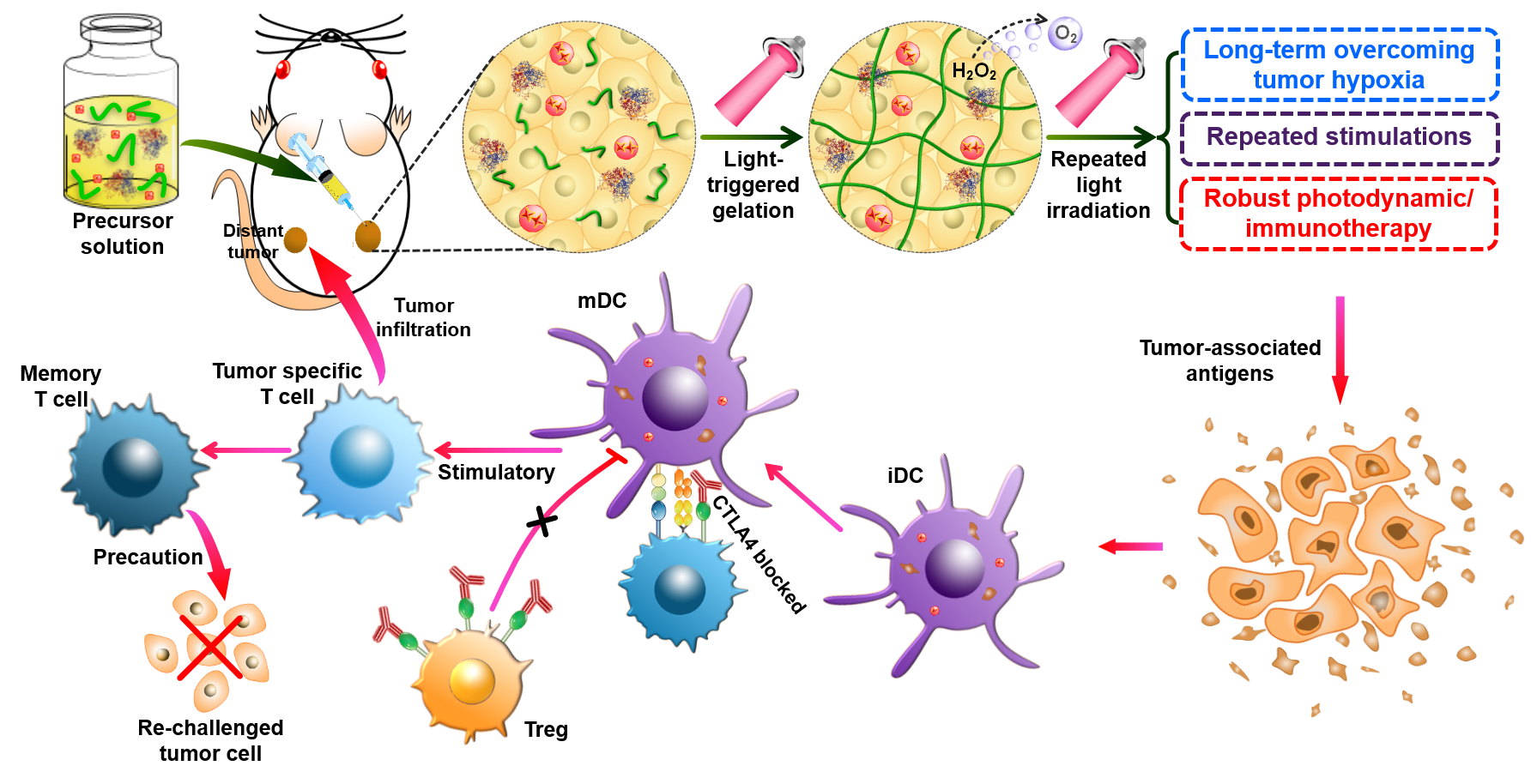
圖1光驅動可注射水凝膠的原位聚合及其對腫瘤的光動力/免疫聯合治療示意圖
該研究結果表明,聚合形成的水凝膠可將Ce6-CAT長期滯留在腫瘤處。其中,Ce6產生的ROS可對腫瘤進行有效的PDT治療;CAT將腫瘤內源性H2O2分解生成O2,以持續改善腫瘤病灶處的乏氧狀態,從而提高PDT的效果;同時,PDT治療后的腫瘤細胞碎片引發免疫原性細胞死亡會產生腫瘤相關抗原,與R837共同作為免疫佐劑,能引起強烈的抗腫瘤免疫效應。此外,相較于單次PDT治療,該研究中通過多次PDT反復激活免疫系統,顯著增強了免疫應答效應。進一步結合使用檢查點抑制劑(α-CTLA4)輔助治療后,可有效抑制遠端(轉移)腫瘤的生長,并產生長期免疫記憶效應以避免腫瘤復發。
相關研究成果發表于Advanced Materials(DOI: 10.1002/adma.201900927)上,該論文的第一作者為蘇州大學博士后孟周琪。
論文鏈接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.201900927
- 廣東省科學院郭會龍/廣州紅會醫院于鋒、林穎 MTB:微環境調控可注射水凝膠在中耳-乳突炎性缺損修復領域的新應用 2025-05-17
- 西南醫大口腔醫院陶剛/黎春暉/蔡蕊團隊:具有ROS觸發藥物釋放特性的可注射水凝膠實現抗菌劑和抗炎納米顆粒協同遞送用于牙周炎治療 2025-04-15
- 吉林大學劉鎮寧教授/王冰迪博士團隊 Adv. Sci.:亞精胺功能化可注射水凝膠減輕炎癥反應,促進急性和糖尿病傷口愈合 2024-04-17
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
- 蘇大鐘志遠/鄧超、蘇大附一院朱曉黎 Nat. Commun.:腫瘤血管適應性、粘附性和可吸收性微球用于可持續的經動脈化學栓塞治療 2025-07-09
- 常州大學王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 香港中文大學(深圳)唐本忠院士團隊 ACS Nano:基于AIEgen的可見光穿透器用于深層組織感染的光動力治療 2024-10-21
