糖尿病性潰瘍(DU)是糖尿病的一種慢性并發癥,以慢性傷口(也稱為開放性潰瘍)的形式出現,通常出現在足部和腿部,有時也出現在其他皮膚皺褶處。DU導致的非創傷性截肢的主要原因是由于宏觀和微血管損傷的神經病變引起的。而引起DU的主要原因包括:(1)糖尿病高血糖癥狀引起微血管內皮細胞損傷、血管擴張功能障礙,進而導致組織供氧減少;(2)血管功能障礙進一步導致組織缺血缺氧,形成慢性創傷;(3)潰瘍開放、創面愈合時間延長、高血糖環境使創面更易感染;(4)傷口感染的加重會促進細菌的繁殖,延緩傷口愈合,并且部分患者伴有不同程度的疼痛問題。因此,促進內皮細胞增殖,激活血管生成,促進局部新生血管和外周血流動,減少細菌感染和炎癥,緩解疼痛是促進創面愈合和DU治療中需要考慮的幾個重要因素。
目前臨床上用于治療DU的方法主要包括傷口清創、減少感染、控制體重和病人教育。這些治療可以緩解疼痛,并有助于預防感染。但這些方法對加速傷口愈合的治療作用不大。雖然一些新的治療方法如組織工程產品、創面敷料和自體創面移植物在治療慢性DU方面取得了一些進展,但在出現疼痛癥狀的DU患者治療過程中有效的疼痛緩解仍是沒有很好的辦法解決。盡管這些成熟的傷口治療方法有一定的療效,但由于慢性傷口、血管生成受損、持續疼痛、細菌感染和炎癥加重的綜合作用,有效治療慢性DU仍然是一個重大的臨床挑戰。因此,如果能夠通過一種單一高效的策略來解決所有這些DU相關的問題,將會十分有臨床前景。
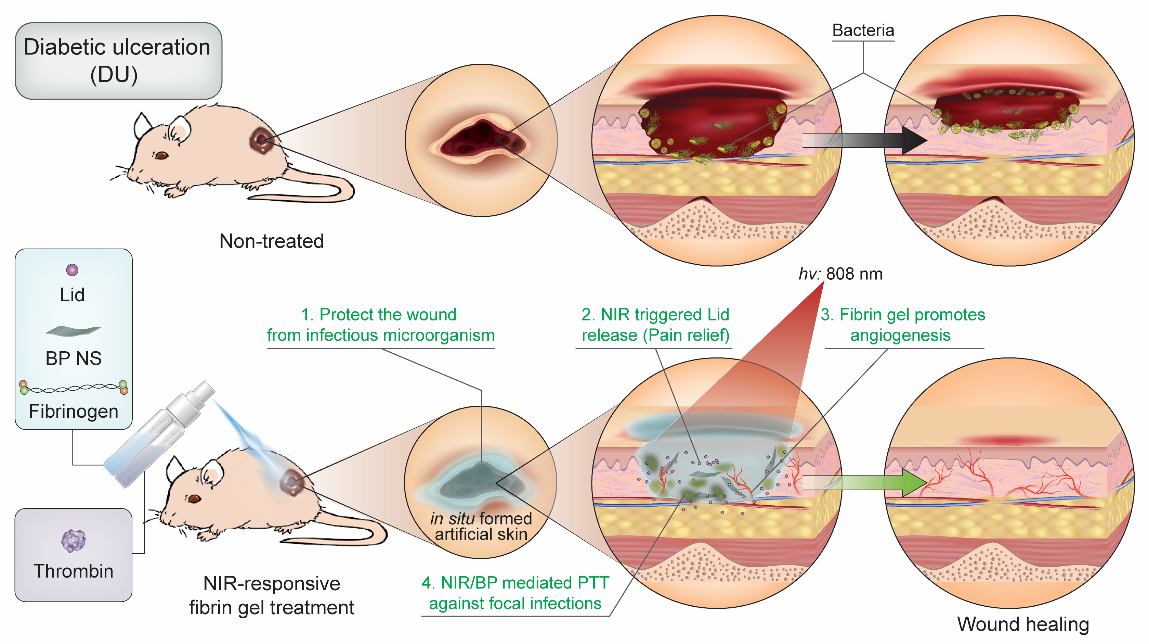
圖1. 原位噴霧形成的NIR響應的鎮痛型凝膠在糖尿病潰瘍治療中加速傷口愈合的示意圖。
近期,哈佛大學醫學院的陶偉教授團隊在《美國國家科學院院刊》(PNAS)上,發表了題為“In situ sprayed NIR-responsive, analgesic black phosphorus-based gel for diabetic ulcer treatment”的研究工作,將黑磷(BP)納米片應用拓展到DU的治療上,并通過這一種策略初步解決了上述這些DU相關的問題。由于簡單的組成,良好的可降解性和顯著的相容性,二維單元素納米材料一直在生物醫藥應用領域備受關注(Chem. Soc. Rev. 2019, 48(11): 2891-2912)。其中,BP納米片研究引人注目,由于其優異的物理、化學、電子和光學性能,BP在生物傳感器、生物成像、治療藥物和診療等方面被廣泛探究(Matter 2020, 2(2): 297-322)。陶偉教授團隊也長期致力于BP方面的研究(Adv. Mater. 2017, 29(1): 1603276;Nano Lett. 2020, 20(5): 3943-3955;Nat. Commun. 2020, 11(1): 2778),并在最近這項工作中開發的基于BP的水凝膠具備了原位噴涂、近紅外響應、鎮痛消炎等的多種作用(PNAS 2020, 117(46): 28667-28677)。
這種功能化凝膠主要包含:(1) FDA批準的具有良好的生物相容性,適合簡單的噴涂,以及通過促進血管生成來愈合傷口等優點的纖維蛋白原和凝血酶; (2) 易于降解為無毒磷酸鹽離子的光熱劑BP納米片; (3) FDA批準的麻醉藥鹽酸利多卡因。這種工程化的黑磷基凝膠噴涂后可以作為類似于人工“皮膚”的存在,不僅可以臨時保護傷口組織與外部環境的接觸、促進內皮細胞增殖和血管化。同時,也可以作為一種藥物的“儲存庫”,并且可以通過近紅外激光激活產生局部熱量加速微血管中血液流動、按需觸發釋放鹽酸利多卡因緩解疼痛,以及通過光熱治療消除細菌和減少炎癥。

圖2. BP基凝膠的表征。(A) BP納米片的TEM圖。(B) BP 納米片的AFM圖。(C) BP 納米片的厚度曲線。(D)大塊BP和BP 納米片的拉曼光譜。(E)凝膠的SEM圖像。(F) BP@Gel的偽彩色SEM圖像。(G) BP@Gel的EDX分析。(H) Gel和BP@Gel的數碼照片。(I)不同BP NSs濃度的纖維蛋白原/凝血酶凝膠的凝膠時間: (1) 0 μg/mL,(2) 50 μg/mL,(3) 100 μg/mL。
上述論文的第一作者為哈佛大學醫學院和中南大學聯合培養的博士研究生歐陽江,中南大學的劉又年教授和鄧留教授對該工作提供了重要幫助,瑞典卡羅林斯卡學院的曹義海院士和韓國大學的Jong Seung Kim院士為該工作提供了重要指導,哈佛大學醫學院的陶偉教授為該工作的獨立通訊作者。
論文信息:Ouyang J, et al. In situ sprayed NIR-responsive, analgesic black phosphorus-based gel for diabetic ulcer treatment. Proceedings of the National Academy of Sciences of the United States of America 2020, 117(46): 28667-28677.
https://www.pnas.org/content/117/46/28667
通訊作者簡介:
陶偉,2015在清華大學獲得理學博士學位。隨后,在哈佛大學醫學院Omid C. Farokhzad教授團隊擔任NIH資助的博士后研究員,并于2018年受聘為哈佛大學醫學院講師(Instructor)、2020年晉升哈佛大學醫學院助理教授(Assistant Professor)。研究方向主要包括藥物載體和生物材料的設計和合成,探索它們的體內交互作用機制和廣泛的生物醫學應用(如RNA遞送、癌癥診斷治療、傷口愈合、心血管疾病和糖尿病治療)。近五年以第一作者和通訊作者身份在PNAS (1), Nature Reviews Materials (1), Science Translational Medicine (2), Nature Biomedical Engineering (1), Matter (4), Nature Communications (3), Chemical Society Reviews (2), Accounts of Chemical Research (1), Progress in Materials Science (1), Advanced Materials (2), Angewandte Chemie (3), Nano Today (2), ACS Nano (3), Nano Letters (2), Advanced Science (1)等刊物上發表論文40余篇,獲得美國METAvivor青年研究員獎、哈佛大學醫學院麻醉系基礎科學基金、Khoury Innovation Award、Stepping Strong Breakthrough Innovator Award、美國心臟協會(AHA)合作科學獎、哈佛大學醫學院助理教授啟動基金(Start-up Package)等基金的資助。
課題組網頁:https://scholar.harvard.edu/wtao/bio
(課題組長期招聘聯合培養博士后、博士研究生,歡迎發信聯系、期待和大家一起進步。)
- 北理工賀志遠教授團隊 Nat. Commun.: 新型結冰預警水凝膠器件在防/除冰領域的突破性研究 2025-05-29
- 阿克倫大學鄭潔教授課題組 Chem. Soc. Rev.: 從分子設計到工程應用 - 系統闡述防凍水凝膠研究進展 2025-05-26
- 浙江大學曲紹興教授團隊 Macromolecules:鹽析與力學訓練下水凝膠的增強/自增強行為與機理研究 2025-05-26
- 南大學羅丙紅教授團隊《Compos. Part B-Eng.》:黑磷納米片協同光熱效應促細胞礦化和骨再生 2024-03-12
- 《Nat.Commun.》: 銅(II)離子負載的黑磷納米片,一種高效的光熱劑用于PET指導的聯合癌癥治療 2020-06-09
- 北航程群峰教授團隊PNAS:黑磷交聯石墨烯超韌薄膜材料的仿生構筑 2020-04-13
