骨關節炎(OA)導致膝關節疼痛和功能障礙,已成為人類最致殘的關節疾病之一,其發展可歸因于關節軟骨及軟骨細胞外基質(ECM)發生降解、滑膜炎癥以及軟骨下骨重塑。活化的巨噬細胞是聚集炎癥反應的生物標志物,也是炎癥性疾病診斷和治療的主要靶點。促炎的M1型巨噬細胞極化為抗炎的M2型是有效緩解炎癥并改善組織修復的策略之一。乏氧微環境可誘導HIF-1α表達上調,影響巨噬細胞極化平衡。病理狀態下高水平的活性氧(ROS)往往介導關節炎癥的發展,不僅誘導氧化應激和細胞凋亡,還可通過NF-κB信號通路激活M1巨噬細胞極化,加劇炎癥反應。因此,清除細胞內ROS和緩解乏氧可以有效阻斷M1表型極化并增強M2表型極化。
適當調節骨免疫微環境(BIM)以促進骨組織修復和再生是逆轉OA病理變化的關鍵措施。M2表型巨噬細胞的轉化可以適當調節BIM,參與骨組織的修復和再生。促進巨噬細胞和間充質干細胞(MSC)之間的相互作用,有利于協調骨分化和骨整合過程。因此,開發一種多功能納米藥物通過多角度治療OA的病理過程有望提高OA的療效。
纖連蛋白(FN)是ECM中的一種主要非膠原糖蛋白,在介導細胞與細胞表面相互作用中發揮著至關重要的作用。他們之前的工作表明,納米顆粒的FN涂層使其能夠特異性靶向高表達整合素αvβ3的腫瘤細胞,從而增強藥物傳遞效率并提高腫瘤的治療效果(ACS Nano 2022, 16, 984-996)。采用苯硼酸修飾的聚酰胺-胺樹狀大分子可將FN高效遞送至肺泡巨噬細胞內,引導脂多糖(LPS)活化的巨噬細胞向抗炎M2表型極化,減少促炎因子分泌,增強ROS清除,從而舒緩急性肺損傷的癥狀(Biomacromolecules 2023, 24, 886-895)。將納米技術與FN相結合可有效發揮FN的抗炎和抗氧化功效,這對促進OA治療至關重要。
含磷樹狀大分子具有與蛋白質相似的精確分子結構、理想的剛性和免疫調節活性,已被開發用于增強基因遞送、抗腫瘤治療和抗炎治療。本課題組先前構建了亞磷酸鈉鹽修飾的含磷樹狀大分子膠束用于負載姜黃素,通過整合載體和藥物的抗炎特性可有效治療急性肺損傷(Theranostics 2022, 12, 3407-3419)。氮雜雙二甲基磷酸酯修飾的第4代含磷樹狀大分子(G4-TBP)具有優異的抗炎作用,通過降低M1型巨噬細胞標志物的表達,并阻斷NF-κB從細胞質到細胞核的快速易位,可有效抑制小鼠亞慢性炎癥的發展。然而,由于G4-TBP的水溶性差且缺乏對巨噬細胞的靶向特異性,限制了其應用范圍。
具有ROS響應性的納米藥物制劑如膠束、聚合物納米顆粒或水凝膠已被開發用于緩釋藥物并減輕炎癥微環境中的氧化應激。此外,采用修飾靶向肽如葉酸、透明質酸或利用細胞膜仿生技術可以使納米藥物靶向至炎癥部位,提高生物相容性和延長體內循環時間。因此,構建將G4-TBP和FN共負載的ROS響應性納米藥物制劑有望通過FN介導的巨噬細胞靶向性能和發揮兩者的生物學功能來協同調節骨微環境以治療OA。
為解決以上問題,東華大學史向陽教授團隊與法國國家科學研究中心配位化學實驗室Jean-Pierre Majoral院士團隊合作構建了一種共負載G4-TBP和FN的ROS響應性聚合物納米顆粒用于OA的抗炎/抗氧化/骨分化聯合治療(圖1)。研究團隊首先將G4-TBP樹枝狀大分子負載到兩親性嵌段共聚物聚乙二醇-縮硫酮-聚乳酸-乙醇酸(HOOC-PEG-TK-PLGA)組裝的納米顆粒中,進一步將形成的具有羧酸表面的G4-TBP NPs通過酰胺鍵與FN共價結合,得到G4-TBP NPs-FN。所制備的納米藥物在生理條件下穩定,在ROS存在下可以解離釋放FN和G4-TBP,并通過FN介導的靶向特異性靶向巨噬細胞,從而顯著提高FN和樹狀大分子的生物利用度。形成的G4-TBP NPs-FN在ROS清除、緩解缺氧、M2型巨噬細胞極化、抗凋亡以及為干細胞成骨分化產生有利的BIM等方面發揮綜合作用,可通過募集骨髓間充質干細胞和成骨分化,抑制軟骨基質降解和促進軟骨修復有效治療骨關節炎。

圖1. G4-TBP NPs-FN的制備及其通過巨噬細胞極化、緩解氧化應激和促進干細胞成骨分化用于聯合治療OA。
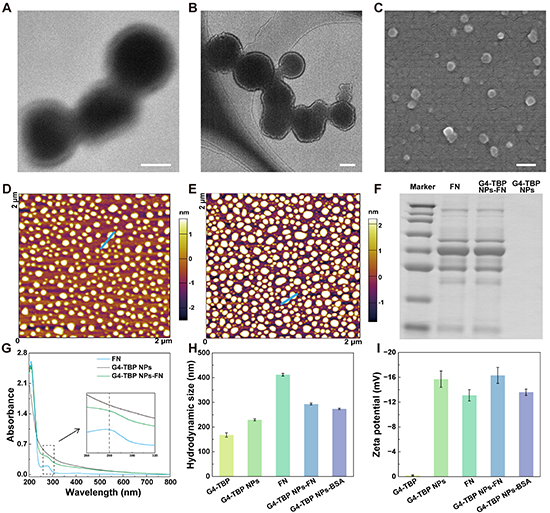
圖2.(A)G4-TBP NPs的TEM圖像;G4-TBP NPs-FN的(B)TEM圖像和(C)SEM圖像;(D)G4-TBP NPs和(E)G4-TBP NPs-FN的AFM圖像;(F)G4-TBP NPs-FN的SDS-PAGE分析結果;(G)G4-TBP NPs、FN和G4-TBP NPs-FN的紫外可見吸收光譜;各材料的水合粒徑(H)和電勢(I)。

圖3.(A)不同材料處理后RAW264.7細胞表面CD86和CD206表達水平的流式檢測結果;(B)不同組RAW264.7細胞M2/M1的比率;(C)不同材料處理后RAW264.7細胞中Arg-1和iNOS的表達水平;(D-E)WB實驗分析巨噬細胞p-PI3K/ p-Akt以及NF-κB通路;不同材料處理后,RAW264.7細胞中(F)TNF-α、(G)IL-1β和(H)IL-4的ELISA分析;(I)RAW264.7細胞凋亡情況代表性流式細胞術圖和(J)定量分析圖。

圖4. 用不同材料處理后RAW264.7細胞中(A)BMP-2和(B)GPNMB的相對mRNA表達的定量分析;與不同材料及其巨噬細胞培養基孵育后BMSCs中(C)Runx2和(D)OCN的相對mRNA表達水平;(E)用不同巨噬細胞培養基培養的BMSC的ALP活性;(F)BMSCs的ALP染色和茜素紅染色結果。對于(A-B),Ⅰ,PBS;Ⅱ,LPS;Ⅲ,LPS+G4-TBP;Ⅳ,LPS+FN;V,LPS + G4-TBP NPs-BSA;VI,LPS + G4-TBP NPs-FN。


研究團隊進一步研究了G4-TBP NPs-FN治療的潛在機制。體內結果顯示,G4-TBP NPs-FN可有效清除ROS,顯著降低HIF-1α的水平以緩解體內氧化應激和乏氧情況(圖7A-D)。體內滑膜巨噬細胞的iNOS和CD206免疫熒光染色結果表明,G4-TBP NPs-FN處理后成功誘導M2巨噬細胞極化,有效發揮其抗炎作用,抑制體內滑膜炎(圖7E)。此外,BMSCs可以被募集到骨組織中并分化為成骨細胞,參與骨再生過程。免疫組織化學染色結果表明,G4-TBP NPs-FN組中CD146(MSC的表面標志物)、BMP-2和OCN陽性細胞數量較高(圖7F-I),證明G4-TBP NPs-FN治療可有效募集BMSC用于成骨分化以修復軟骨。

圖7.(A)體內發光圖像和(B)不同治療后小鼠健康膝蓋和OA膝蓋的相對L-012發光強度;(C)WB分析和(D)不同治療后小鼠膝關節相對HIF-1α表達;(E)滑膜區域iNOS和CD206蛋白標記物的免疫熒光染色;(F)骨組織中CD146、BMP-2和OCN的代表性免疫組織化學染色。不同處理后(G)CD146、(H)BMP-2和(I)OCN陽性染色細胞的定量分析。
簡而言之,該研究設計的納米藥物具有以下優勢:1)有效提高了G4-TBP的水溶性和FN的細胞內遞送效率,并使含磷樹枝狀大分子和FN在炎癥微環境中響應釋放;2)不僅利用FN的RGD序列主動靶向巨噬細胞,而且將G4-TBP和FN各自固有的生物活性充分結合,通過清除ROS和緩解缺氧,有效緩解過度氧化應激并保護細胞免于凋亡,從而抑制關節軟骨退化和滑膜炎的發生;3)通過巨噬細胞極化為M2型、骨間充質干細胞募集和成骨分化刺激來調節BIM,進一步促進骨修復和骨整合。所開發的納米藥物制劑結合了生物活性含磷樹狀大分子和FN治療OA的優勢,有望用于不同炎癥性疾病的免疫調節治療。
文章鏈接:https://doi.org/10.1021/acsnano.4c00909
- 東華大學史向陽教授團隊 JCIS:電噴霧制備核殼微球共遞送纖連蛋白與白藜蘆醇協同治療急性肺損傷 2025-02-04
- 東華大學史向陽教授團隊 BAM:具有自身生物活性的羥基化含磷樹狀大分子腦內遞送纖連蛋白協同調節小膠質細胞實現帕金森病的增強治療 2024-04-26
- 上海交大路慶華教授團隊 Adv. Sci.:一種基于點擊化學制備的纖連蛋白修飾型細胞層用于傷口修復 2024-01-10
- 東華大學沈明武研究員/史向陽教授團隊:不對稱含磷樹狀大分子遞送菠蘿蛋白酶用于骨關節炎的抗炎和軟骨保護治療 2025-06-13
- 東華大學沈明武/史向陽團隊《Acta Biomater.》:含磷樹狀大分子介導的生物礦化用于協同的腫瘤阻斷治療與乏氧激活化療 2025-04-28
- 東華大學史向陽教授團隊 Nano Today:基于含磷樹狀大分子的藥物遞送系統協同增強自噬、抗炎和抗氧化治療阿爾茨海默癥 2025-02-11
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
