近紅外(NIR)響應藥物遞送系統利用NIR激光觸發受控藥物釋放,并表現出高靶向能力、可調節的藥物釋放、高效的藥物利用和低毒性。由于組織穿透深度和靶向能力的不足,一些光敏劑的光熱轉換效率受到阻礙。貴金屬納米結構表現出強表面等離子體共振、優異的光熱轉換能力、良好的生物相容性和低副作用,因此是提高光熱轉換效率以促進傷口愈合的潛在光敏劑。
日前,湖南大學的蔡仁教授團隊設計了一種多功能Pd@Au Nanoframe水凝膠來檢測尿酸(UA),用于原位監測傷口感染,并通過化學-光熱策略促進傷口愈合。在加載抗菌莫匹羅星(M)后,所獲得的M Pd@Au Nanoframe水凝膠顯示出超過90%的莫匹羅星的最大累積釋放速率,由NIR激光照射控制。在體外抗菌實驗中,M Pd@Au Nanoframe水凝膠表現出NIR激光驅動的抗菌能力:98%的大腸桿菌在10分鐘內被有效殺死。用M Pd@Au Nanoframe水凝膠的UA傳感貼片涂覆兔傷口后,可以通過檢測UA濃度實時監測傷口狀態,從而通過化學-光熱策略的新協同效應在4天內快速愈合傷口。這種方法成功地證實了一種閉環策略,即實時監測傷口的狀態并有效地進行化學-光熱傷口治療,通過結合功能性水凝膠、NIR激光照射和藥物抗菌劑來促進傷口愈合。相關工作以“Pd@Au Nanoframe Hydrogels for Closed-Loop Wound Therapy”發表在《ACS Nano》。該工作得到湖南大學譚蔚泓院士,陳卓教授,胡躍強教授的指導和支持。
【Pd@Au Nanoframe的制備與表征】
如圖1所示,TEM 圖像顯示了異質結構的形成,即在六方納米框架的表面形成了許多納米顆粒。納米框架和納米顆粒的尺寸分別約為50和4 nm。高倍率TEM圖像清楚地顯示孔的尺寸分布在0.2-3 nm的范圍內。通過所選區域電子衍射圖樣觀察到多晶特征,這與XRD圖樣的結果一致。所有峰都可以歸類為Pd(JCPDS:23–0345)和Au(JCPDS:04–0784)的晶相。同時,0.225和0.235 nm的晶格條紋分別對應于Pd的(111)平面和Au的(111)平面的d間距。TEM元素映射圖像證實了Au和Pd元素的分布。在本報告中,異質結構被稱為Pd@Au Nanoframe。
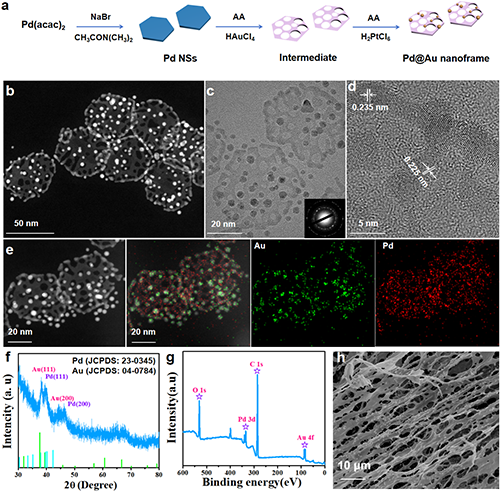
圖1. Pd@Au Nanoframe:(a) 合成過程。(b-c) 透射電鏡圖像;(d) 高分辨率透射電鏡圖像;(e) 元素映射。(f) XRD圖譜。(g) XPS光譜。(h) Pd@Au Nanoframe水凝膠的掃描電鏡圖像。
【Pd@Au Nanoframe 水凝膠的光熱性能及藥物輸送性能】
在808 nm近紅外激光照射下(1 W/cm2)300s,溶液溫度隨著Pd@Au Nanoframe濃度的增加而升高。在紅外熱成像中,Pd@Au Nanoframe水凝膠溶液的顏色從0 s的深藍色到300 s的紅色變化,表明在808 nm NIR激光照射下溫度升高非常快。經過5次NIR激光照射實驗后,每個循環的最高溫度沒有觀察到顯著變化,證實了Pd@Au Nanoframe 水凝膠優異的光熱穩定性。這些結果表明,Pd@Au Nanoframe 水凝膠具有優異的光熱轉換性能,可用作潛在的NIR光敏劑。如圖2所示,計算溶脹率并繪制為溶脹曲線。在37 °C和25 °C下觀察到的溶脹率分別為24.23%和23.35%,這證明了M Pd@AuNanoframe水凝膠的優異溶脹性能。隨后,通過紫外-可見光譜法測試了M Pd@AuNanoframe水凝膠的莫匹羅星負載能力,并獲得了標準的莫匹羅星負載曲線。同時,計算了莫匹羅星負載能力和吸光度之間的線性關系:A = 0.01245 + 0.04489C。在這里,對于 5 mg/mL 莫匹羅星和 10 mg/mL 的溶液,莫匹羅星負載量分別為 0.0534 和 0.0335。
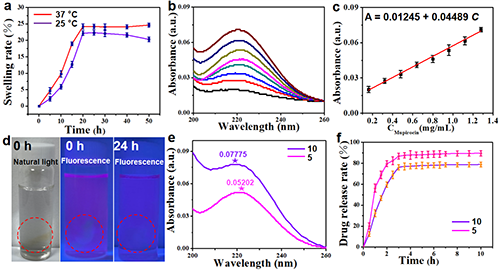
圖2. (a) M Pd@Au Nanoframe水凝膠的溶脹性能。(b) 莫匹羅星溶液(0.16、0.32、0.48、0.64、0.8、0.96、1.12、1.28 mg/mL)的紫外-可見光譜。(c) 紫外-可見吸收與莫匹羅星濃度的關系。(d) 室溫下用羅丹明B染色24小時的M Pd@Au Nanoframe水凝膠的照片。(e) 負載10 mg/mL(紫色線)和5 mg/mL(粉色線)莫匹羅星溶液的Pd@Au Nanoframe水凝膠的紫外-可見光譜。(f) 負載莫匹羅星的Pd@Au Nanoframe水凝膠的莫匹羅星釋放曲線(10 mg/mL(紫色線)和5 mg/mL(粉色線))。
【體外抗菌性能及體內傷口愈合評價】
如圖3所示,在對照樣品和水凝膠組中,大腸桿菌表面光滑,大腸桿菌活力保持在98%以上,表明僅靠近紅外激光照射不能殺死大腸桿菌。在Pd@AuNanoframe水凝膠組中,91%的大腸桿菌被殺死。對于M Pd@AuNanoframe水凝膠組,基于兩個協同效應殺死了98%的大腸桿菌。這些結果表明,M Pd@AuNanoframe水凝膠表現出過氧化物酶樣活性和出色的 NIR 激光響應性莫匹羅星遞送,從而產生高效的協同抗菌活性。對于兔子傷口的治療,Pd@Au Nanoframe水凝膠和M Pd@Au Nanoframe水凝膠之間的光熱轉換效率沒有顯著差異,證明了 Pd@Au Nanoframe作為優秀光敏劑的潛力(如圖5所示)。

圖3. (a) 體外酸性條件下的抗菌過程。(b) 大腸桿菌在瓊脂平板上的菌落,分別經過與水凝膠、Pd@Au Nanoframe水凝膠以及M Pd@Au Nanoframe水凝膠孵育后,有或沒有NIR激光照射。(c) 層狀膜在808 nm NIR激光照射下(1 W/cm2,10 min)與水凝膠、Pd@Au Nanoframe水凝膠和M Pd@Au Nanoframe水凝膠孵育后的抗菌率。(d) 兔傷口處使用UA傳感貼片的水凝膠、Pd@Au Nanoframe水凝膠和M Pd@Au Nanoframe水凝膠的紅外熱圖像,在808 nm NIR激光照射下(1 W/cm2)。(e) 兔傷口處使用UA傳感貼片的水凝膠、Pd@Au Nanoframe水凝膠和M Pd@Au Nanoframe水凝膠在NIR激光照射期間的溫度變化。

圖4. M Pd@Au Nanoframe水凝膠的(a) NIR激光響應藥物遞送及智能手機讀取測試結果。(b)佩戴M Pd@Au Nanoframe水凝膠UA傳感貼片的兔子。(c) 第0、1、2、3和4天兔子傷口區域的照片。(d) 相對傷口面積。
總結:作者制備的M Pd@AuNanoframe水凝膠的UA傳感貼片可以實時監測傷口狀態,并通過對兔子進行化學-光熱治療的新協同效應在4天內加速傷口快速愈合。這種創新方法提供了一種閉環策略,即實時監測傷口狀態和化學-光熱傷口治療,通過結合功能性水凝膠、光熱效應和藥物抗菌劑來促進傷口愈合。
- 澳門大學李奕雯課題組 Sci. Adv.:同心冰模板法制備具有仿生環向纖維結構的強韌水凝膠 2025-06-25
- 合工大秦海利、從懷萍/中科大俞書宏 Adv. Mater.: 在超強韌水凝膠材料領域取得重要突破 2025-06-24
- 四川大學冉蓉、崔為 Adv. Mater.:基于本體共聚實現無溶劑制備強韌物理水凝膠 2025-06-23
- 港中深唐本忠、趙征/深大熊玉 ACS Nano:細胞膜偽裝的多重刺激響應型AIE納米凝膠用于腫瘤的精準化學-光熱協同治療 2023-12-17
- 青島大學于冰教授團隊 Small:具有快速止血和廣譜抗菌特性的寡肽水凝膠用于加速傷口愈合 2025-06-03
- 川大華西口腔醫學院甘雪琦教授課題組 CEJ: 具有調控免疫反應及促線粒體轉移的新型水凝膠促進糖尿病慢性傷口愈合 2025-05-21
- 福州大學林子俺研究員團隊 AFM:一種具有自氧化特性的鄰位二羥基廣譜抗菌共價有機框架水凝膠用于促進糖尿病傷口愈合 2025-05-06
