8月23日,《自然-通訊》(Nature Communications)在線發(fā)表華中科技大學生命學院、國家納米藥物工程技術(shù)研究中心楊祥良教授、甘璐教授課題組完成的研究論文“Tumor exosome-based nanoparticles are efficient drug carriers for chemotherapy”。
腫瘤干細胞(Cancer stem cells, CSCs)是導致腫瘤復發(fā)、轉(zhuǎn)移和耐藥的主要原因,發(fā)展靶向CSCs的策略是腫瘤臨床治療最有效的策略之一。納米藥物具有增強滲透滯留效應(yīng)(EPR)、可修飾性、智能響應(yīng)性以及多種藥物共輸送等獨特的性質(zhì),在腫瘤精準協(xié)同治療、增強療效和降低毒副作用等方面發(fā)揮著重要作用。納米材料常通過偶聯(lián)靶向分子實現(xiàn)抗腫瘤藥物靶向輸送,但不同CSCs表達不同的表面標志物,如何將藥物高效運送到不同CSCs并發(fā)揮作用是目前腫瘤治療亟待解決的難題。
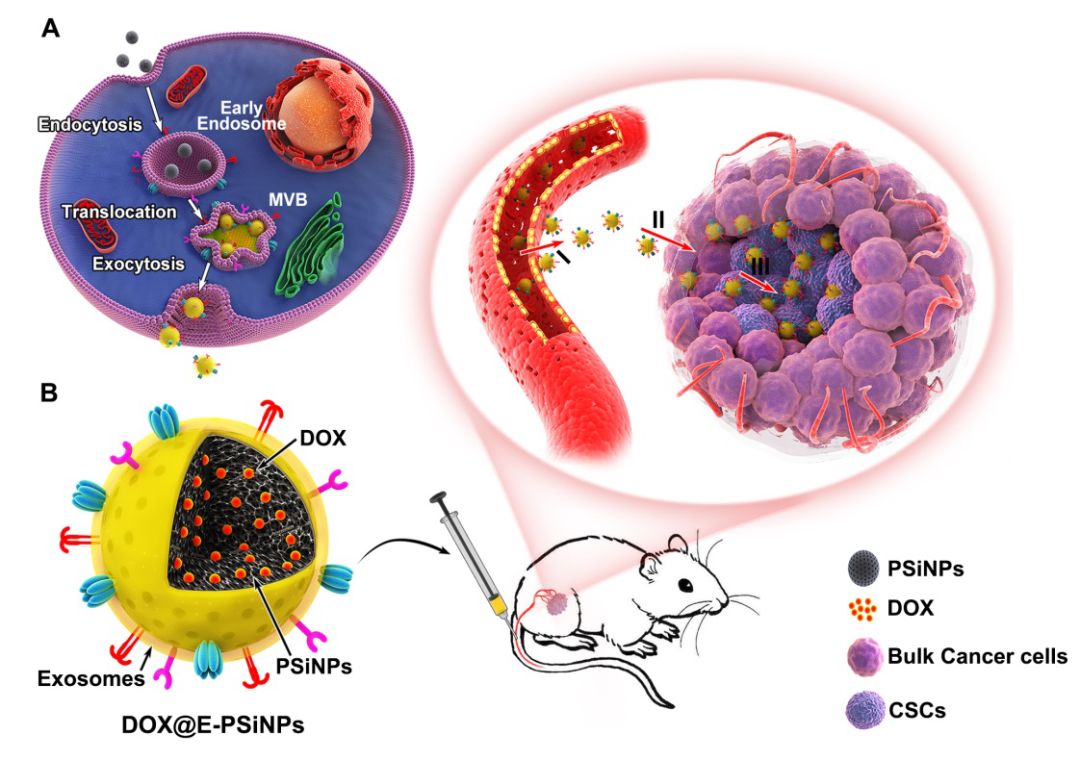
近年來,楊祥良教授團隊提出了抗腫瘤納米藥物靶向輸送的“五得原則”:跑得動(Long circulation)、停得下(Tumor targeting)、鉆得深(Deep penetration)、進得去(Cellular internalization)、放得出(Drug release)。仿生納米藥物結(jié)合天然生物材料的獨特功能及人工納米材料的多功能性特點,在用于藥物遞送方面引起廣泛關(guān)注。外泌體(exosomes)是細胞分泌的胞外囊泡,具有長循環(huán)、生物相容性好、免疫原性低等優(yōu)點,更為重要的是外泌體能夠表達特定的蛋白,具有“歸巢”靶向能力,可被用于藥物載體。但構(gòu)建外泌體仿生納米藥物面臨外泌體產(chǎn)量過低、傳統(tǒng)超聲擠壓易導致外泌體蛋白功能丟失進而影響靶向效率等問題。
本研究構(gòu)建了一種腫瘤細胞外排的外泌體仿生多孔硅納米粒(E-PSiNPs)用于CSCs的靶向給藥。將多孔硅納米粒與腫瘤細胞孵育,發(fā)現(xiàn)腫瘤細胞會通過自噬(autophagy)促進多孔硅外排,且通過免疫熒光、western blot等多種手段鑒定外排的多孔硅表面覆蓋著厚約20 nm的外泌體膜結(jié)構(gòu)。相比于傳統(tǒng)外泌體分離方式可使其產(chǎn)量提高34倍,且有效保留了外泌體的功能蛋白。E-PSiNPs具有良好的普通腫瘤細胞和CSCs靶向性,且來源于一種腫瘤細胞的E-PSiNPs負載抗腫瘤藥物阿霉素后(DOX@E-PSiNPs),表現(xiàn)出對其他不同普通腫瘤細胞和CSCs的交叉攝取與有效殺傷效果,解決了靶向不同CSCs需要偶聯(lián)不同靶向分子的問題。另外,DOX@E-PSiNPs具有良好的腫瘤組織靶向性、腫瘤血管滲出并穿透至腫瘤深部能力,這些作用與E-PSiNPs表面表達黏附分子CD54有關(guān)。基于上述獨特的行為,DOX@E-PSiNPs實現(xiàn)了在腫瘤組織內(nèi)腫瘤細胞和CSCs中的大量蓄積,在肝癌皮下瘤、原位乳腺癌和黑色素瘤肺轉(zhuǎn)移等多種腫瘤模型中均表現(xiàn)出良好的抗腫瘤和殺傷CSCs的能力。該研究為腫瘤細胞來源的外泌體仿生納米藥物用于腫瘤治療提供了新思路。
華中科技大學生命學院楊祥良教授、甘璐教授及芬蘭赫爾辛基大學Helder A. Santos教授為本論文的共同通訊作者,華中科技大學生命學院博士后雍土瑩、博士生張曉瓊、別娜娜以及芬蘭埃博學術(shù)大學張宏博博士為該論文共同第一作者。該工作得到了國家重點研發(fā)計劃和國家自然科學基金等項目的資助。
- 廈門大學曹學正教授 Macromolecules:高強高黏超流體動態(tài)高分子網(wǎng)絡(luò)的仿生設(shè)計及跨尺度流變理論模擬揭秘 2025-07-03
- 太原理工大學張虎林教授 Adv. Sci.: 熱電凝膠賦能仿生多模自監(jiān)督指尖受體 2025-07-02
- 西南大學康燕堂/徐立群/徐琨 Adv. Mater.:空心普魯士藍納米框架仿生增強梯度抗菌涂層 2025-07-01
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內(nèi)遞送 2025-05-03
- 川大李旭東/陳君澤、港城大譚超良團隊 Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續(xù)流生產(chǎn) 2025-02-12
- 天工大高輝/李曉暉團隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導的結(jié)直腸癌化療耐藥與免疫抑制 2025-02-11
- 山東大學劉新宇、崔基煒教授交叉團隊 ACS Nano:靶向遞送與肝-骨軸調(diào)控協(xié)同治療骨質(zhì)疏松 2025-06-29
