腫瘤引流淋巴結(tumor-draining lymph node, tdLN)是腫瘤細胞轉移的門戶,也是適應性免疫應答發生的始發部位。雖然引流淋巴結中富集有大量樹突狀細胞(DCs)和淋巴細胞,但持續過量的腫瘤分泌物刺激及調節性 T 細胞(TRegs)積累,引發免疫耐受,抑制了DCs成熟及效應T細胞活化擴增,無法產生有效的抗腫瘤作用,導致腫瘤細胞逃逸并轉移。因此,逆轉腫瘤引流淋巴結的局部免疫抑制,增強腫瘤抗原特異性的效應 T 細胞活化擴增,重塑抗腫瘤免疫微環境,是改善腫瘤免疫治療效果亟待解決的科學問題。
針對這一問題,中國海洋大學孔明教授團隊采用納米復合自溶微針設計,以透明質酸(HA)自溶微針為基質,負載納米傳遞體,傳遞體表面裝配甘油單硬脂酸(GMS)修飾的透明質酸(T-HA-GMS),表面連接 CD40蛋白抗體(αCD40),內部包載免疫佐劑PolyI:C、相關抗原,結合αPD1復合給藥,構建腫瘤引流淋巴結靶向疫苗。復合疫苗能夠自發調控疫苗輸送和特異性免疫應答,逆轉腫瘤引流淋巴結免疫抑制,增強抗腫瘤效應。
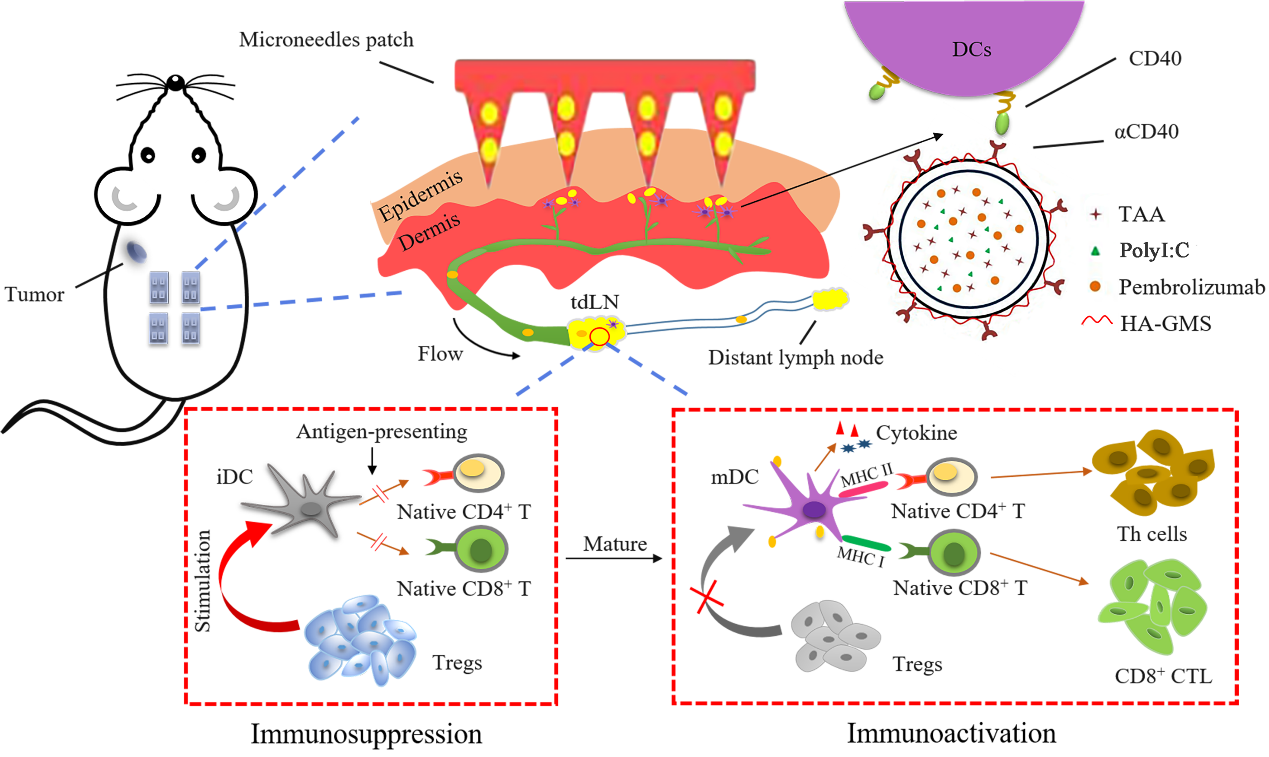
圖1. 功能化傳遞體通過微針經皮給藥靶向tdLNs并誘導免疫應答示意圖
該團隊利用黑色素瘤(B16F10)荷瘤小鼠模型通過激光共聚焦掃描顯微鏡定性觀察和細胞流式計數定量統計表明,復合傳遞體能明顯提高DCs細胞攝取量,促進細胞因子的表達,減少TRegs在tdLNs中累積,增加了效應T淋巴細胞的腫瘤浸潤。

圖2. 復合傳遞體在器官中分布以及特異性抗體、細胞因子表達
團隊通過表面αCD40靶向設計實現了復合傳遞體淋巴靶向作用,并且避免了藥物在心臟、肝臟、脾臟以及腎臟中的首過效應,促進IFN-γ和 IL-2 的表達,更重要的是復合傳遞體能明顯的激起Th1型細胞免疫偏向。
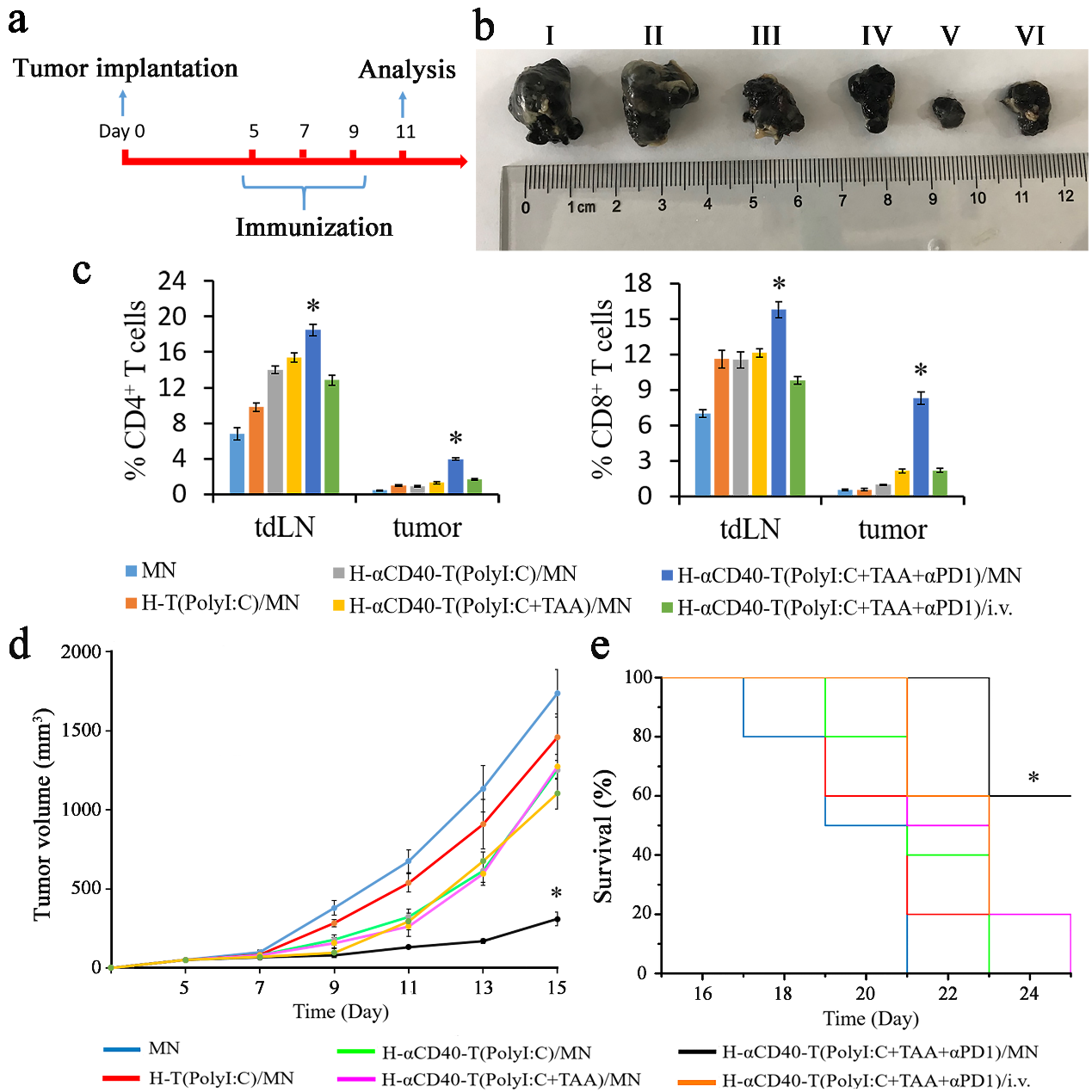
圖3. 納米復合微針疫苗聯合αPD1治療延長荷瘤小鼠生存時間。
該團隊實現了傳遞體淋巴結靶向輸送、樹突狀細胞識別攝取及成熟、胞內定位、抗原交叉呈遞、效應 T 細胞活化擴增及浸潤腫瘤,逆轉腫瘤引流淋巴結免疫抑制。在腫瘤免疫的研究和臨床應用方面提供了新思路。
本研究以Reverse immune suppressive microenvironment in tumor draining lymph nodes to enhance anti-PD1 immunotherapy via nanovaccine complexed microneedle為題發表于Nano research,中國海洋大學為該論文第一單位,博士生周忠政為文章第一作者,孔明教授為論文通訊作者,論文共同作者為中國海洋大學海洋生物材料研究團隊帶頭人陳西廣教授。本項目得到了國家自然科學基金的資助。
論文鏈接:https://link.springer.com/article/10.1007/s12274-020-2737-5
- 東華大學郭睿教授/史向陽教授課題組 Acta Biomater.:仿生納米平臺介導的缺氧-腺苷軸破壞和PD-L1敲除用于增強MRI引導的化學動力學/免疫治療 2025-06-27
- 東華大學史向陽教授 Nano Today:仿生金屬-多酚網絡包覆彈性蛋白樣多肽膠束實現原位腦膠質瘤的聲動力/化學動力/免疫治療 2025-05-28
- 南華大學魏華/喻翠云/張海濤團隊 CRPS:環刷拓撲結構球形核酸通過中性粒細胞極化增強肝細胞癌基因-免疫治療 2025-05-04
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
- 常州大學王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 中山大學吳丁財/黃榕康/鄭冰娜/王輝團隊 Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實現腫瘤的協同治療 2025-07-04
