盡管納米載藥系統(tǒng)有助于提高藥物的溶解性和穩(wěn)定性、改善藥物的循環(huán)時間和靶向性、降低藥物的毒副作用,納米藥物通過靜脈給藥時不可避免的面臨多重生物屏障,如血液屏障、組織屏障和細(xì)胞屏障等,導(dǎo)致其在臨床試驗中收益甚微。內(nèi)源性細(xì)胞具備天然的遞送優(yōu)勢,如長循環(huán)能力、自然的隱身性能以及定向遞送能力等,有望攜同納米載藥系統(tǒng)共同克服各種生物屏障,提高藥物的生物利用度。中科大王育才教授課題組曾提出利用中性粒細(xì)胞對細(xì)菌的特異性識別,使用細(xì)菌外膜囊泡實現(xiàn)對循環(huán)中性粒細(xì)胞的高效劫持。并利用微光熱處理腫瘤組織觸發(fā)局部炎癥微環(huán)境誘導(dǎo)中性粒細(xì)胞的浸潤,實現(xiàn)了細(xì)菌外膜囊泡包裹的納米藥物的高效遞送,從而徹底的清除殘留的腫瘤細(xì)胞,抑制了腫瘤復(fù)發(fā)[1]。
然而,納米藥物經(jīng)靜脈注射后,會在其表面被動的吸附上一層血漿蛋白質(zhì),形成蛋白質(zhì)冠。蛋白質(zhì)冠的形成會屏蔽納米藥物表面配體的靶向作用,甚至導(dǎo)致表面修飾被降解,進(jìn)而限制了納米藥物與內(nèi)源性細(xì)胞的特異性結(jié)合。在前期的研究基礎(chǔ)上,該課題組提出通過調(diào)控載體特性實現(xiàn)對其表面蛋白質(zhì)冠的主動精準(zhǔn)調(diào)控,并利用蛋白質(zhì)冠實現(xiàn)內(nèi)源性中性粒細(xì)胞的劫持,進(jìn)而利用中性粒細(xì)胞的天然遞送優(yōu)勢實現(xiàn)納米藥物的高效遞送(圖1)[2]。
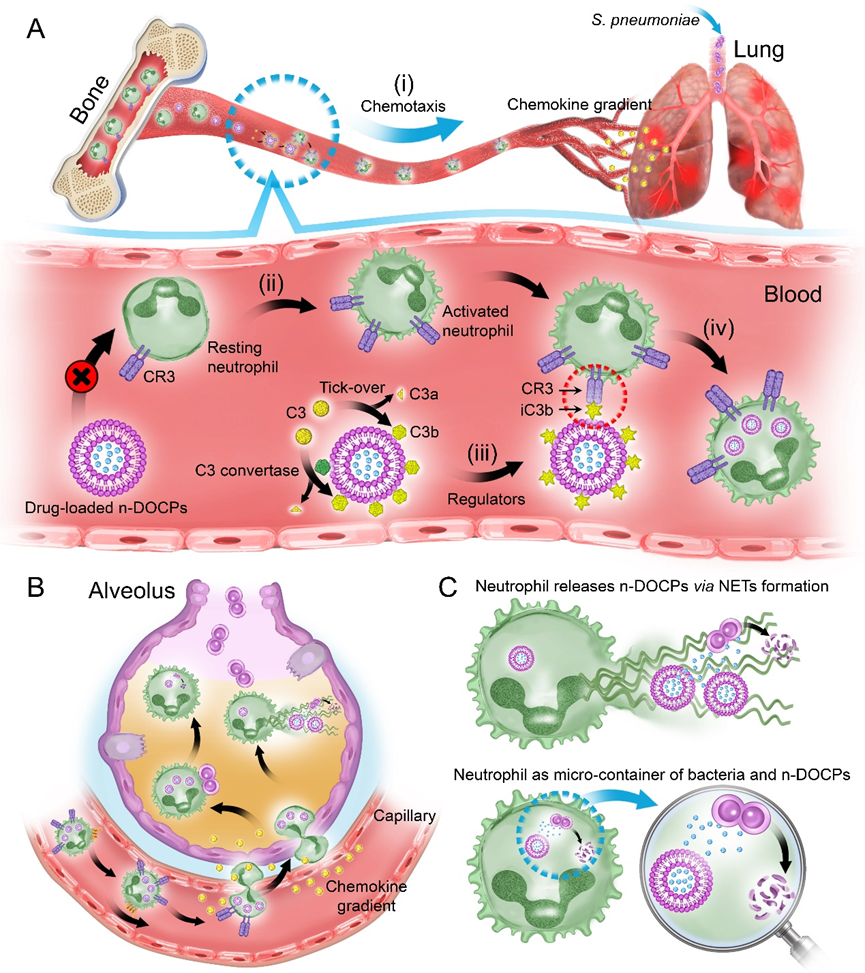
圖1.反轉(zhuǎn)脂質(zhì)體主動誘導(dǎo)補體蛋白吸附用于靶向活化的中性粒細(xì)胞實現(xiàn)藥物高效遞送。
為了評估納米載體表面特性對中性粒細(xì)胞靶向的影響,作者篩選了不同表面特性的脂質(zhì)體,所含脂質(zhì)的疏水尾部一致,而親水頭部的化學(xué)結(jié)構(gòu)和電性不同。通過流式細(xì)胞術(shù)和活體顯微成像實時觀察證明頭部反轉(zhuǎn)的脂質(zhì)體(n-DOCPs)能夠特異高效地靶向血液中活化的中性粒細(xì)胞(圖2)。
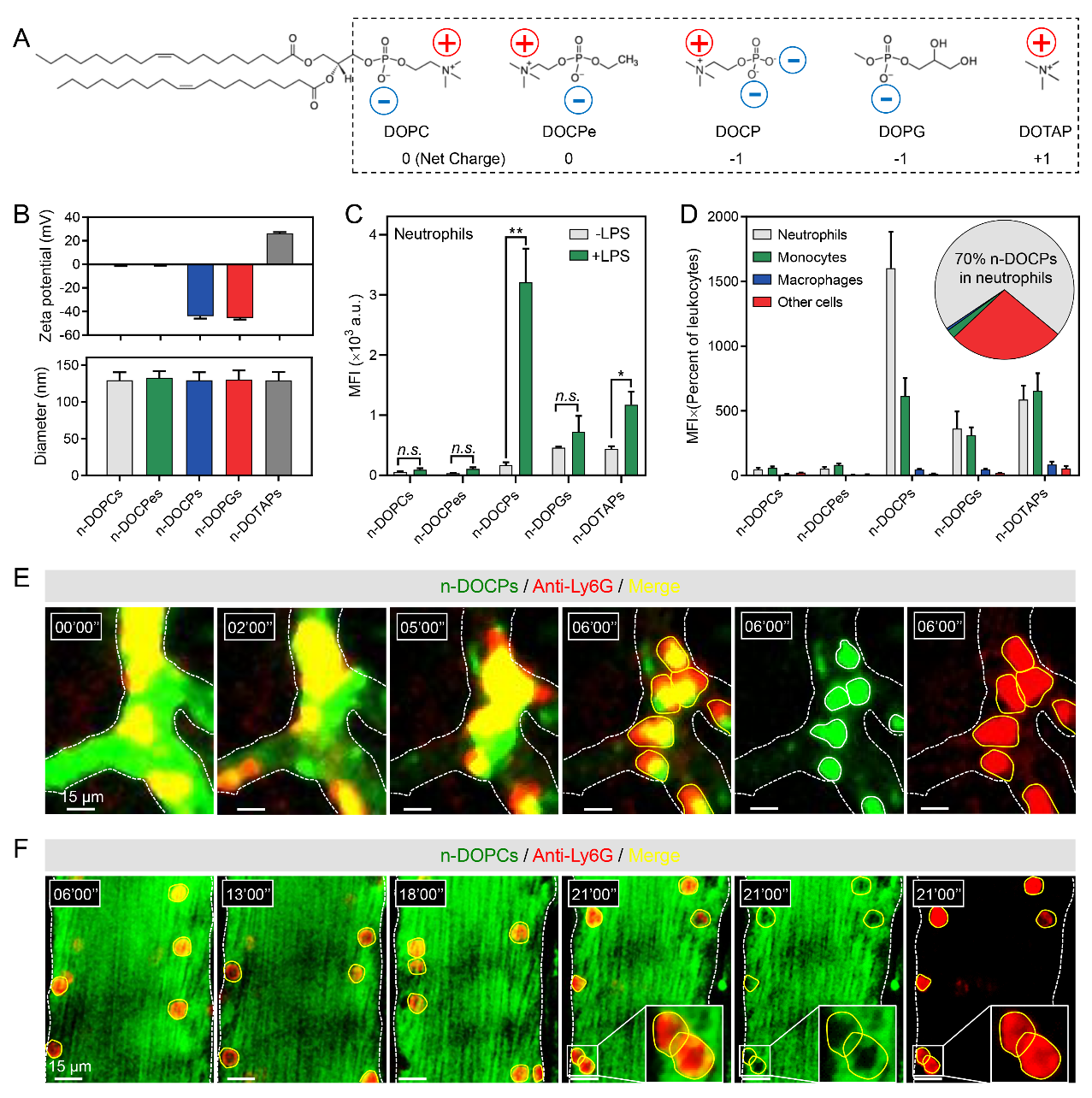
圖2.反轉(zhuǎn)脂質(zhì)體靶向活化中性粒細(xì)胞。
作者接著探究反轉(zhuǎn)脂質(zhì)體高效靶向活化中性粒細(xì)胞的機制,發(fā)現(xiàn)中性粒細(xì)胞的活化狀態(tài)和納米載體表面蛋白質(zhì)冠的組成直接影響了納米載體與中性粒細(xì)胞的親和力(圖3)。證明了反轉(zhuǎn)脂質(zhì)體在血液環(huán)境中能夠自發(fā)的激活補體調(diào)理作用,誘導(dǎo)形成富含補體片段iC3b的蛋白冠。該補體片段能夠特異的與中性粒細(xì)胞表面補體受體CR3相互識別和結(jié)合,誘導(dǎo)中性粒細(xì)胞的吞噬作用。此外,活化的中性粒細(xì)胞會高表達(dá)CR3,從而提高了反轉(zhuǎn)脂質(zhì)體的靶向特異性。據(jù)此證明通過調(diào)控納米載體表面特性能夠改變蛋白質(zhì)冠的組成從而實現(xiàn)對特定細(xì)胞的親和力。

圖3.蛋白質(zhì)冠介導(dǎo)反轉(zhuǎn)脂質(zhì)體靶向活化中性粒細(xì)胞。
其次,作者考察了中性粒細(xì)胞攜載納米藥物能否克服生理屏障實現(xiàn)納米藥物的病灶富集,以及胞內(nèi)納米藥物如果在病灶部位發(fā)揮功效(圖4)。由于肺組織存在肺泡毛細(xì)血管屏障,納米藥物只有突破該屏障才能在病灶部位富集,通過活體顯微成像的實時追蹤觀察、流式細(xì)胞術(shù)分析、以及小動物成像儀檢測證明中性粒胞能夠利用其炎癥趨化作用將納米藥物遞送到炎性肺實質(zhì)中。在病灶部位,中性粒細(xì)胞應(yīng)答炎癥刺激形成細(xì)胞外捕獲網(wǎng)實現(xiàn)納米藥物的釋放。此外,胞內(nèi)菌是克服細(xì)菌耐藥的難題,該體系證明攜載納米藥物的中性粒細(xì)胞不僅能夠釋放藥物,還能作為細(xì)胞反應(yīng)器,將細(xì)菌吞入胞內(nèi),利用胞內(nèi)高濃度的藥物進(jìn)行細(xì)菌的殺傷作用。
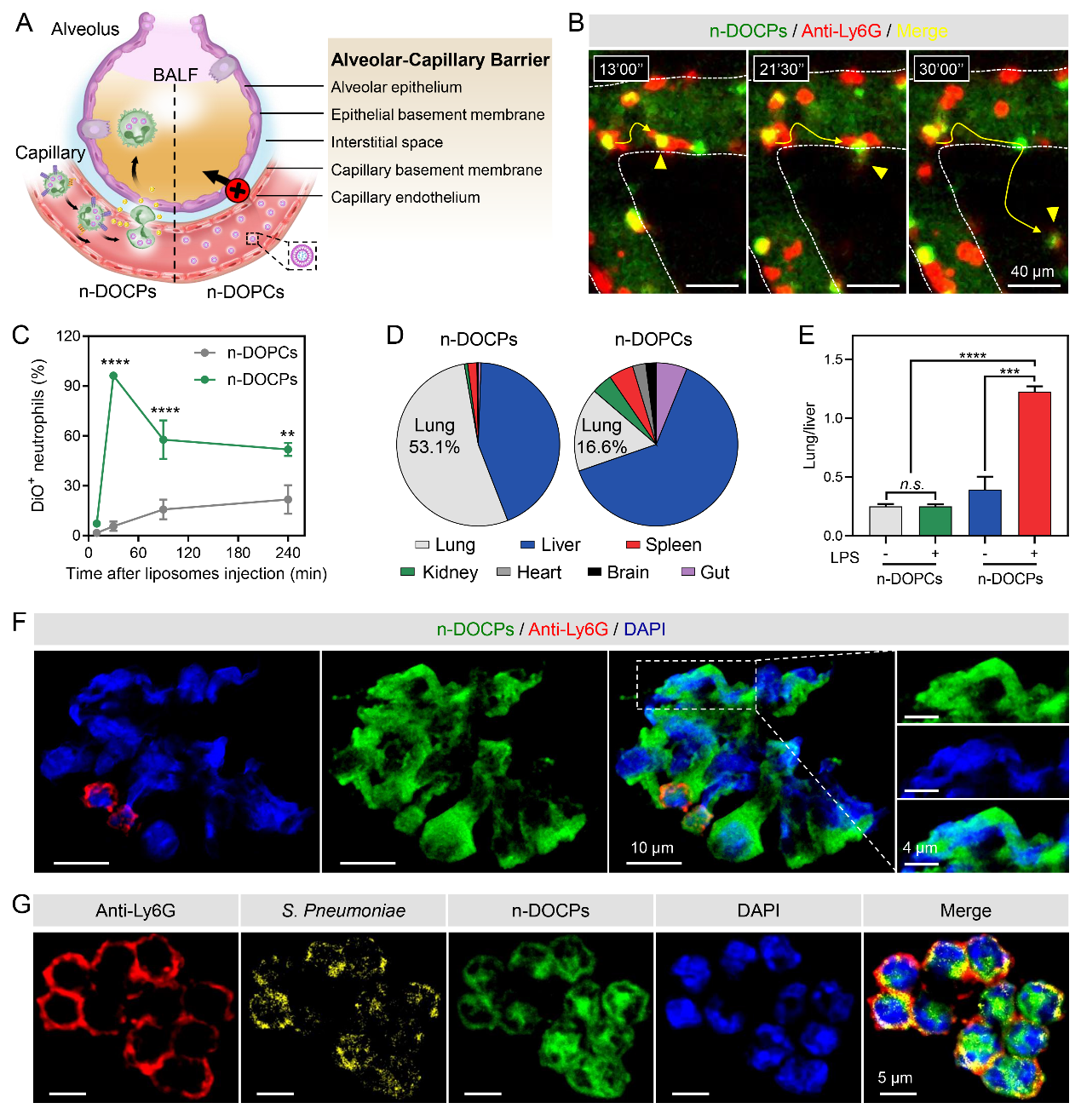
圖4.中性粒細(xì)胞攜載納米藥物克服肺泡毛細(xì)血管障礙并發(fā)揮功效。
作者利用反轉(zhuǎn)脂質(zhì)體包載糖皮質(zhì)激素地塞米松進(jìn)行靜脈注射給藥,有效的緩解了急性肺損傷小鼠的肺炎狀況。在臨床分離的肺炎鏈球菌誘導(dǎo)的小鼠肺炎模型中,通過注射包載氨芐青霉素的反轉(zhuǎn)脂質(zhì)體,有效的控制了細(xì)菌的增殖,抑制了肺炎的爆發(fā),并延長了細(xì)菌性肺炎小鼠的生存期(圖5)。利用納米藥物在給藥過程中自發(fā)形成的蛋白冠實現(xiàn)對循環(huán)細(xì)胞的靶向作用,以增強納米藥物的遞送,這一策略可能為新型藥物遞送系統(tǒng)的開發(fā)帶來新的機遇。
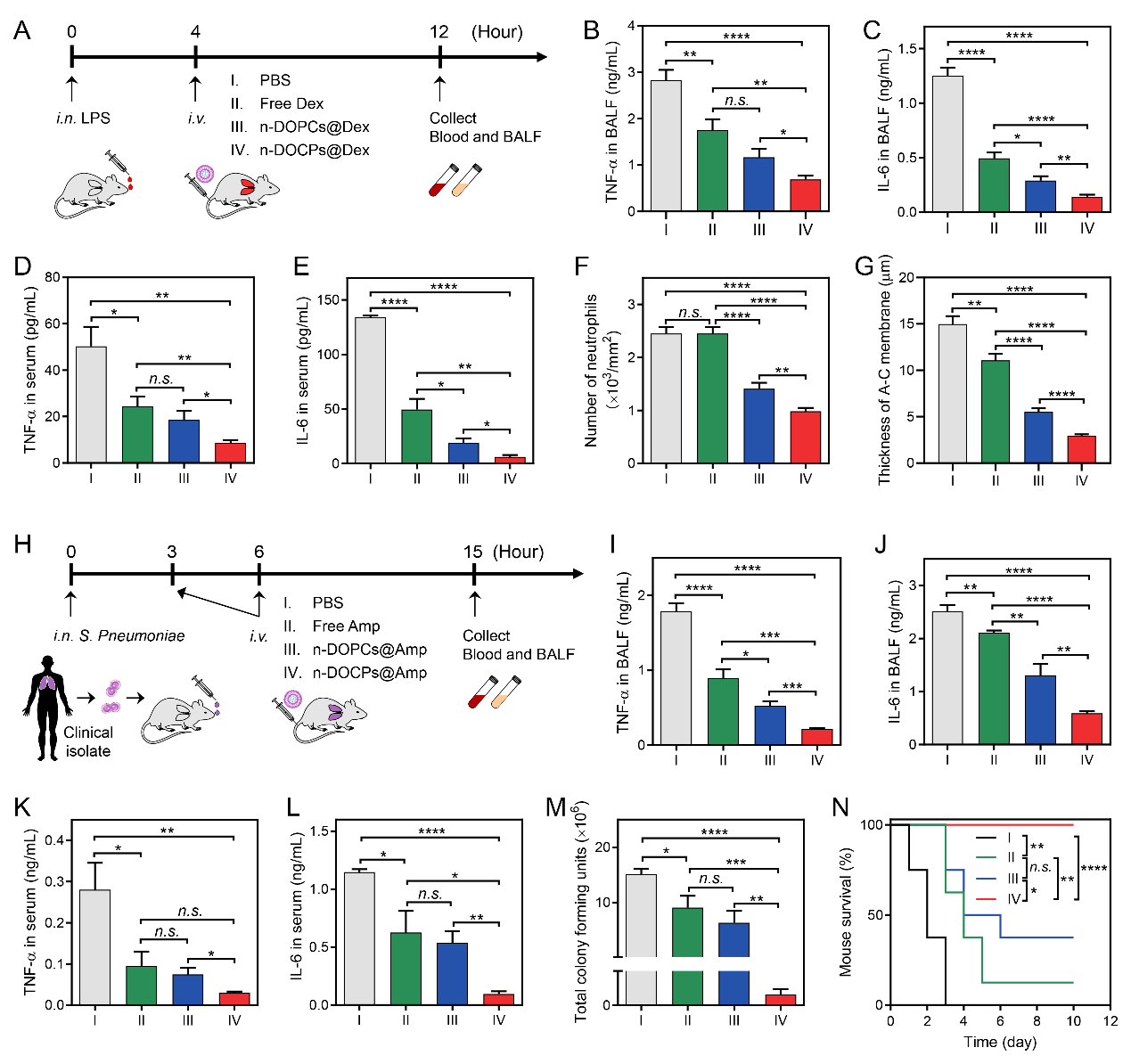
圖5.中性粒細(xì)胞攜載納米藥物減緩急性肺損傷和細(xì)菌性肺炎。
該研究工作近期發(fā)表于Advanced Materials。中國科學(xué)技術(shù)大學(xué)李舒雅博士和李敏博士為文章共同第一作者,中國科學(xué)技術(shù)大學(xué)王育才教授和華南理工大學(xué)王均教授為文章通訊作者。
參考文獻(xiàn)
[1] Li, M., Li, S.Y., Zhou, H., Tang, X.F., Wu, Y., Jiang, W., Tian, Z.G., Zhou, X.C., Yang, X.Z., Wang, Y.C., Chemotaxis-driven delivery of nano-pathogenoids for complete eradication of tumors post-phototherapy. Nature Communications, 2020, 11(1), 1126.
[2] Li, S.Y., Li M., Huo, S.H., Wang, Q., Chen, J., Ding, S.G., Zeng, Z.T., Zhou, W.C., Wang, Y.C., Wang, J., Voluntary-Opsonization-enabled Precision Nanomedicines for Inflammation Treatment. Advanced Materials, 2020, Dec 9, e2006160. doi: 10.1002/adma.202006160. Epub ahead of print. PMID: 33296121.
下載:原文
- 西北大學(xué)范代娣教授、朱晨輝教授、李陽副教授 AM:基于仿生凝血級聯(lián)途徑的多肽修飾脂質(zhì)體納米顆粒可噴涂水凝膠治療不可壓破性創(chuàng)面出血 2025-04-19
- 天津大學(xué)史志遠(yuǎn)教授團(tuán)隊招聘科研助理 - 高分子化學(xué)、微凝膠/微囊泡/脂質(zhì)體、酶包裹遞送載體、微流控 2024-12-17
- 桂工甄士杰/李美靜博士、廣醫(yī)張?zhí)旄桓苯淌凇⑷A工趙祖金教授、港中深唐本忠院士 AM:近紅外二區(qū)脂質(zhì)體多模態(tài)光診療新成果 2024-11-29
- 中科大王育才/蔣為團(tuán)隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內(nèi)遞送 2025-05-03
- 川大李旭東/陳君澤、港城大譚超良團(tuán)隊 Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續(xù)流生產(chǎn) 2025-02-12
- 天工大高輝/李曉暉團(tuán)隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導(dǎo)的結(jié)直腸癌化療耐藥與免疫抑制 2025-02-11
- 蘇大劉莊/楊光保教授團(tuán)隊招聘博士后 - 材料合成、納米醫(yī)學(xué)(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
