相對于傳統的電子閉殼層熒光團,陽離子自由基的基態與激發態能級差較小,有望發展為一類新型的紅至近紅外熒光團,在生物醫學領域具有重要的應用潛力。然而目前文獻中報道的絕大多數陽離子自由基的熒光量子效率很低,例如:經典的陽離子自由基Wurster''s Blue在室溫下的量子效率小于0.1%。另外,陽離子自由基在生理環境下易于發生親核反應、自由基聚合反應等,嚴重限制了陽離子自由基在熒光成像中的應用。
近日,香港中文大學(深圳)唐本忠院士、華南理工大學高蒙副研究員、張云嬌教授和廣西中醫藥大學劉鍇副研究員合作,以2,5-二甲基吡咯為核心骨架,通過修飾鋅(II)-二甲基吡啶胺,制備了P-DPA-Zn化合物,進一步通過空氣氧化,簡便、高效地制備了水相中穩定且深紅光發射的陽離子自由基P?+-DPA-Zn,并成功將其用于突變 p53癌癥診療(圖1)。
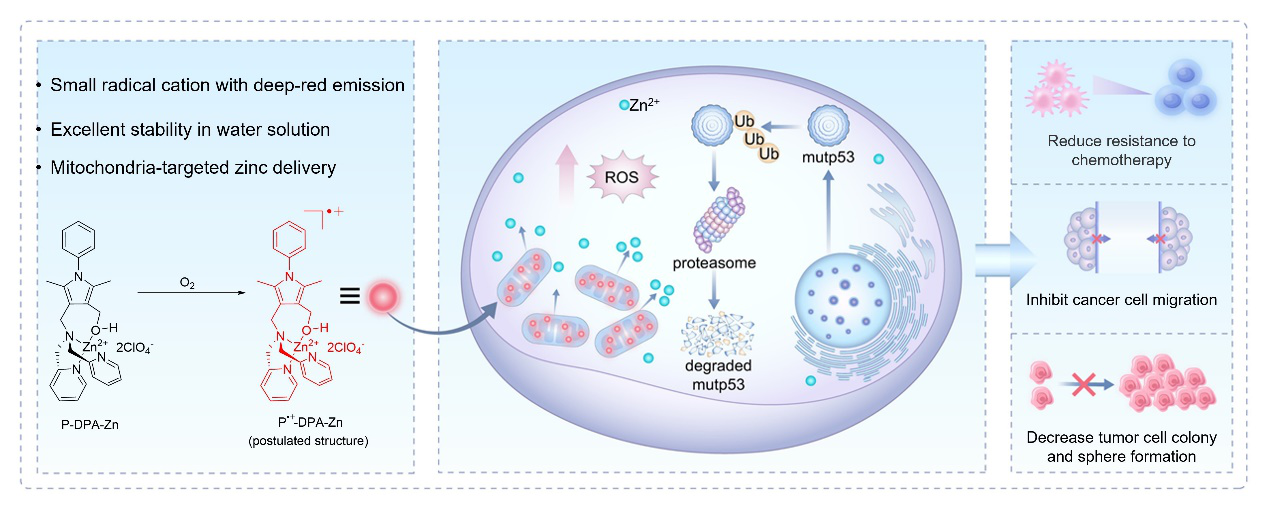
圖1發光陽離子自由基P?+-DPA-Zn的制備及突變 p53癌癥診療
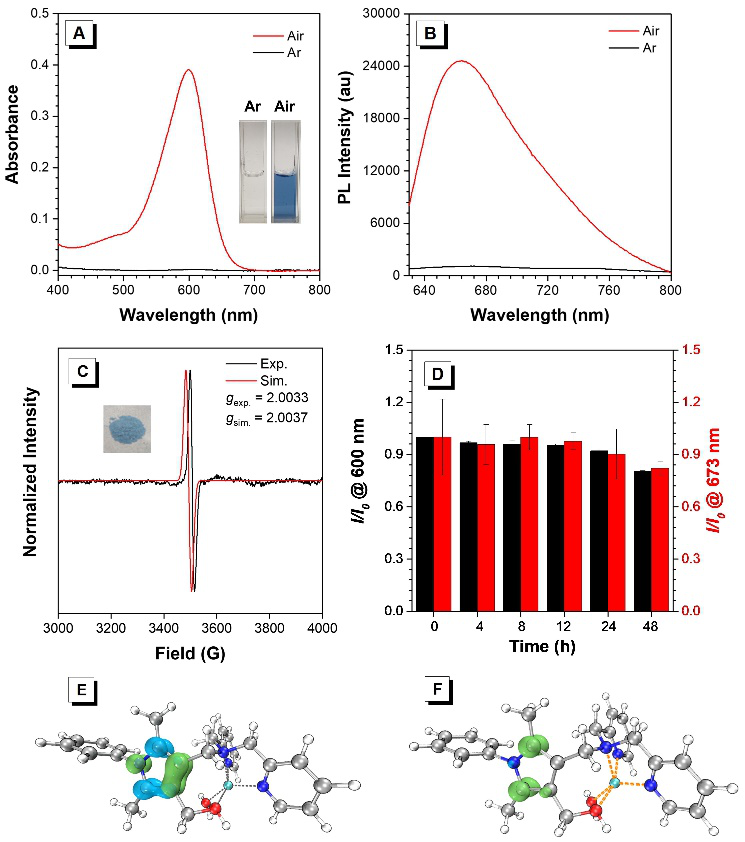
圖2 P?+-DPA-Zn的結構及光物理性質表征與理論計算分析
作者發現陽離子自由基P?+-DPA-Zn具有癌細胞線粒體靶向富集能力,不僅可實現線粒體高信噪比熒光成像,還可用于線粒體靶向鋅離子遞送(圖3),誘導線粒體氧化應激生成活性氧,促進突變p53蛋白與鋅離子結合,進而通過泛素-蛋白酶體途徑降解突變p53蛋白(圖4)。相對于正常細胞和野生型p53癌細胞,P?+-DPA-Zn可選擇性降低突變p53癌細胞存活率,抑制其增殖與遷移,克服其化療耐藥性,消除突變p53的獲得性功能(圖5)。

圖3 P?+-DPA-Zn的線粒體靶向成像及鋅離子遞送

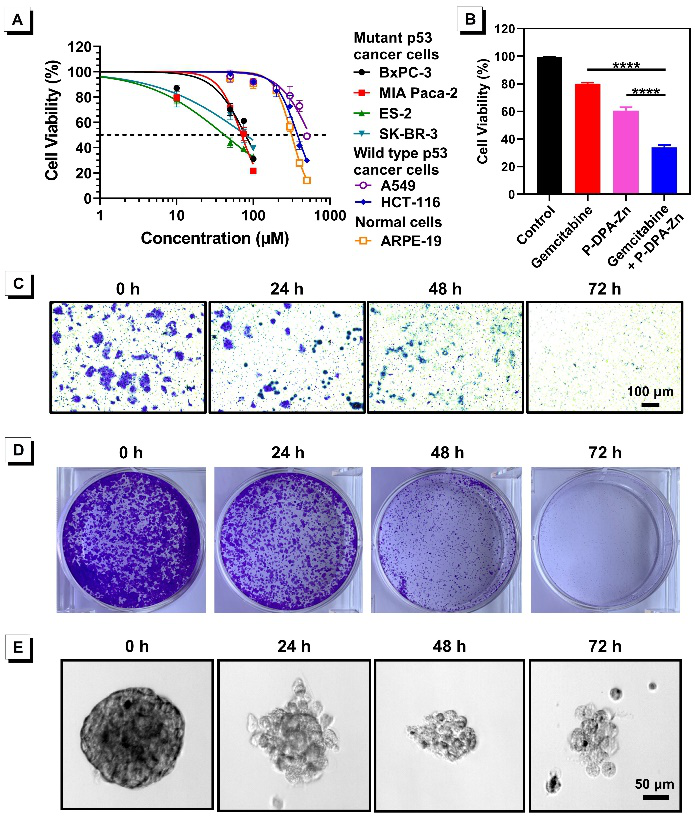
圖5 P?+-DPA-Zn選擇性降低突變p53癌細胞存活率并消除其獲得性功能
本研究首次制備了水相中穩定且深紅光發射的吡咯陽離子自由基,為發光陽離子自由基的構建及生物診療應用提供了一種新策略。
論文信息:
A Water-Stable and Red-Emissive Radical Cation for Mutp53 Cancer Therapy
Zikai Zhou,? Jieying Qian,? Kai Liu,* Yunjiao Zhang,* Meng Gao,* Ben Zhong Tang*
Angewandte Chemie International Edition
DOI: 10.1002/anie.202212671
https://onlinelibrary.wiley.com/doi/10.1002/anie.202212671
- 北京化工大學馬志勇課題組《Chem. Mater.》:一種可替代Bd的有機磷光基元 2022-12-27
- 巴黎高科化學學院李敏慧教授與合作者 JACS: 創新型“類酶”納米材料 → 餓死癌細胞 2025-07-20
- 天工大高輝/馬飛賀/余云健 Small:疏水標簽/低溫光熱協同增強腫瘤治療 2025-07-11
- 常州大學王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
