抗腫瘤納米藥物具有廣泛和迫切的需求,但目前的臨床用納米藥物只能降低藥物的毒副作用,在療效上與原藥相比未有顯著改善。因此,進一步設計創新載體以提高負載藥物的療效是目前納米藥物輸送領域亟待解決的問題。
2019年7月1日,浙江大學申有青教授團隊和加州大學洛杉磯分校(UCLA)顧臻教授團隊合作在Nature Nanotechnology雜志上發表了題為 Enzyme-activatable polymer–drug conjugate augments tumour penetration and treatment efficacy的研究論文,提出了納米藥物在腫瘤組織中主動滲透新機制,有望解決納米藥物在實體瘤中滲透難的瓶頸問題,并用多種動物模型驗證了其在體內顯著的抑瘤效果。
腫瘤靶向納米藥物的體內輸送過程是一個包括從血液循環系統(Circulation)向腫瘤組織內蓄積(Accumulation)、在瘤內滲透擴散(Penetration)以被腫瘤細胞內吞(Internalization)、然后在胞內將藥物釋放(Release)的五步"CAPIR級聯"過程 (circulation, accumulation, penetration,internalization and release)。這種串聯過程的特點使每步都有高的輸送效率成為納米藥物獲得高療效的關鍵,但納米藥物在腫瘤組織內難以滲透擴散是其最大的難題。
腫瘤內部缺少毛細血管網,有非常致密的細胞外基質和非常高的細胞密度,因此即使是小分子溶質也難以從瘤內擴散出來,也由此導致了瘤內高的滲透壓。這些腫瘤組織微環境的特點使氧氣這種很小(0.346 納米)的分子在瘤內也只能擴散100-200 微米處(一到兩根頭發的直徑),藥物分子(幾個納米)在腫瘤組織內的擴散已經非常有限,相對來說體積巨大(粒徑一般在幾十甚至上百納米)的納米藥物在瘤內也就難以移動。因此,納米藥物自身大尺寸的因素和腫瘤組織結構特點導致了目前臨床用納米藥物即使能夠蓄積在瘤內,也難以在瘤內滲透擴散開來到達血管遠處的腫瘤細胞,也就無法完成輸送過程的入胞和胞內釋放兩步,導致療效不理想,這也是眾多新開發的納米藥物臨床實驗失敗的重要原因。
針對上述問題,國內外研究者進行了大量的探索工作,如降低腫瘤組織密度、減小納米藥物尺寸以降低納米藥物在瘤內的滲透阻力,表面修飾可促進組織滲透的功能基團等工作,雖然能在一定程度上提高納米藥物在腫瘤組織內的滲透能力,但大尺寸的納米藥物要在致密的腫瘤內依靠自身的擴散進行被動滲透的機理沒有變,滲透擴散困難的“天然短板”依然存在。
在最新的這項研究中,研究人員巧妙地利用了腫瘤內細胞密度高的特點、讓它們“主動地”在細胞間傳遞納米藥物:即讓細胞從一邊吞噬納米藥物,然后從另一邊將一些納米藥物排到細胞間液中(即胞吞轉運作用),讓鄰層的細胞重復內吞和外排,從而實現不依賴擴散的納米藥物跨細胞傳遞,即“主動”腫瘤滲透。實現這一設想的必要條件是納米藥物能夠被快速內吞。大量的工作表面帶正電的納米藥物具有快速細胞內吞的能力,但關鍵是如何使血液循環系統中呈電中性的或者電負性的納米藥物只在腫瘤的毛細血管內、或外滲進入腫瘤組織后就立即帶上正電,以觸發上述快速細胞內吞和主動腫瘤滲透。
為此,本文作者利用腫瘤血管的內皮細胞上及血管附近腫瘤細胞高表達γ-谷氨酰轉肽酶(GGT)的特點,設計合成了GGT響應性的聚合物PBEAGA及其與化療藥物喜樹堿(CPT)的偶聯物PBEAGA-CPT。PBEAGA以離子對型的γ-谷氨酰基為側基,因而具有高水溶性和電中性及與金標準聚乙二醇(PEG)相當的長血液循環時間。到達腫瘤部位之后,細胞表面的GGT水解掉聚合物上的γ-谷氨酰基而產生胺基,使聚合物帶上正電荷,促使血管表皮細胞或者腫瘤細胞快速內吞陽離子化的偶聯物,進而觸發轉胞吞作用和在腫瘤組織內的跨細胞傳遞(圖1a)。體內滲透實驗表明,納米藥物經尾靜脈注射十分鐘后,PBEAGA-CPT的紅色熒光就已經外滲出腫瘤毛細血管并遍布整個腫瘤區域,不到一小時后整個腫瘤組織內的藥物濃度就和腫瘤血管內的濃度相當(圖1b)。可見,這種依賴細胞耗能的內吞/外排的主動滲透策略能賦予納米藥物在實體瘤中快速滲透分布的能力。

圖1(a) PBEAGA-CPT在腫瘤組織中的主動滲透機理圖;(b)激光共聚焦實時監測PBEAGA-CPT在腫瘤組織中的滲透情況
最后,研究者用多種動物模型考察了PBEAGA-CPT在體內的抑瘤效果,結果表明,尾靜脈注射的PBEAGA-CPT不僅能完全治愈起始體積為100立方毫米的小腫瘤(圖2a),而且對于難以治療的、已處于指數增長、達500立方毫米大腫瘤,尾靜脈給藥后腫瘤體積迅速萎縮變得很小,停藥半月后也未見明顯反彈,抑瘤率高達98%(圖2b)。最后研究者還挑戰了號稱癌癥之王的“胰腺癌”,建立了胰腺癌原位模型,發現與臨床一線藥物吉西他濱相比,PBEAGA-CPT顯著抑制腫瘤的生長而大大延長了實驗小鼠的存活期(圖2c)。
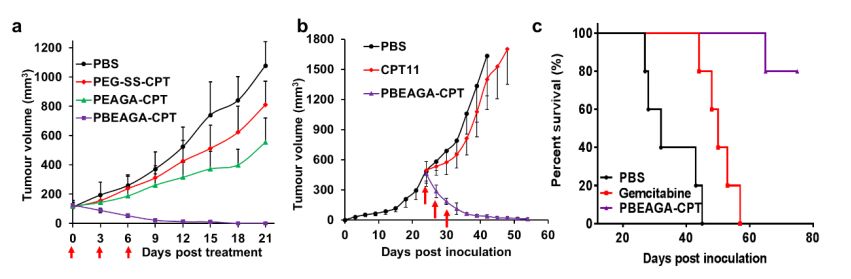
圖2 PBEAGA-CPT在多種動物模型中的抑瘤效果圖
值得一提的是,這種化被動滲透為主動滲透的策略,使納米藥物避開了腫瘤組織致密微環境構成的天然生物屏障,克服了納米藥物大尺寸導致擴散能力低的天然缺陷,有望解決納米藥物在腫瘤組織內滲透難的問題,為下一階段納米藥物的設計開辟了新的思路。下一步,研究者將在人源動物模型中進一步驗證其抑瘤效果,為潛在應用于臨床做好準備。同時研究者也在嘗試利用類似的方法輸送其它抗腫瘤藥物、將延展其成為平臺化技術的可能。
值得一提的,Nature Nanotechology雜志同期還發表了題為Transcellular transfer of nanomedicine的News & Views的評論文章,對上述工作進行了highlight。
原文鏈接:https://www.nature.com/articles/s41565-019-0485-z
本文經授權轉載自微信公眾號BioArt。
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內遞送 2025-05-03
- 川大李旭東/陳君澤、港城大譚超良團隊 Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續流生產 2025-02-12
- 天工大高輝/李曉暉團隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導的結直腸癌化療耐藥與免疫抑制 2025-02-11
- 常州大學王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 中山大學吳丁財/黃榕康/鄭冰娜/王輝團隊 Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實現腫瘤的協同治療 2025-07-04
- 東華大學郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環境調控光熱/催化療法 2025-06-19
- 山東大學劉新宇、崔基煒教授交叉團隊 ACS Nano:靶向遞送與肝-骨軸調控協同治療骨質疏松 2025-06-29
